 |
Классификация буферных систем
|
|
|
|
1. Кислотные – буферные системы, содержащие слабую кислоту и ее соль (ацетатная, бикарбонатная, фосфатная, белковая, гемоглобиновая).
2. Основные – буферные системы, содержащие слабое основание и его соль (аммиачная).
3. Буферные системы, представляющие собой ионы и молекулы амфолитов (белковая).
Механизм буферного действия
(на примере бикарбонатной буферной системы).
При добавлении сильной кислоты:
NaHCO3 + HCl → NaCl +H2CO3
Na+ + HCO3 - + H+ + Cl- → Na+ + Cl- + H2CO3
HCO3- + H+ → H2CO3
При добавлении сильного основания:
H2CO3 + NaOH → NaHCO3 + H2O
H2CO3 + Na+ + OH- → Na+ + HCO3- + H2O
H2CO3 + OH- → HCO3- + H2O
Таким образом, буферное действие раствора обусловлено смещением кислотно-основного равновесия за счет связывания добавляемых в раствор ионов H+ и OH-. В результате реакций ионов H+ и OH- и компонентов буферной системы образуются слабодиссоциирующие продукты.
Уравнение Гендерсона-Гассельбаха для расчета рН буферных систем.
Для буферных систем кислотного типа:
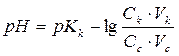
Для буферных систем основного типа:
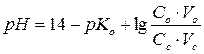
Буферная емкость характеризует способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей. Буферная емкость определяется количеством сильной кислоты или сильного основания (в моль или в моль эквивалента), при добавлении которого к одному литру буферного раствора значение рН меняется на единицу.


Вопросы для самоконтроля
1. Водородный показатель. Интервалы рН для различных биологических жидкостей.
2. Общая, активная и потенциальная кислотность раствора слабого электролита.
3. Понятие буферного раствора. Классификация буферных растворов. Свойства буферных растворов.
4. Уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного и основного типов.
|
|
|
5. Буферная емкость. Формулы для расчета буферной емкости по кислоте и по щелочи. Факторы, влияющие на буферную емкость.
Задания для самоконтроля
1. Распределите перечисленные системы по соответствующим столбцам таблицы.
а) С6Н5СООН + С6Н5СООК;
б) HCl + NaCl;
в)HCOOH + HCOONa;
г)HNO3 +KNO3; Д)HNO2 + KNO2.
| Обладает буферным действием | Не обладает буферным действием |
Дайте мотивированный ответ.
2. С помощью стрелок обозначьте соответствие между столбиками. Допишите сокращенные ионные уравнения, объясняющие механизм буферного действия систем.
| Тип буферной системы | Буферная система | Состав буферной системы | Механизм буферного действия |
| Кислотная Основная Амфотерная | Ацетатная Белковая Бикарбонатная Аммиачная Фосфатная Формиатная | H2CO3 NaHCO3 | H2CO3 + OH- → HCO3- + H2O HCO3- + H+ → H2CO3 |
| PtCOOH PtCOONa | PtCOOH + OH- → PtCOO- + H+ → | ||
| NH4OH NH4Cl | NH4OH + H+ → NH4++ OH- → | ||
| NaH2PO4 Na2HPO4 | H2PO4 - + OH- → HPO42-+ H+ → | ||
| HCOOH HCOOK | HCOOH+ OH- → HCOO-+ H+ → | ||
| CH3COOH CH3COONa | CH3COOH+ OH- → CH3COO- + H+ → |
3. Определите концентрацию протонов в растворе, полученном при смешивании 30 мл раствора CH3COOH с молярной концентрацией эквивалента 0,1 моль/л и 50 мл раствора CH3COONa с молярной концентрацией эквивалента 0,3 моль/л, если рК(CH3COOH) = 4,75.
4. Рассчитайте рН раствора, полученного при смешивании 20 мл раствора HCl с молярной концентрацией эквивалента 0,05 моль/л и 20 мл раствора NaHCO3 с молярной концентрацией эквивалента 0,1 моль/л, если рК(H2CO3) = 6,35.
5. Вычислите рН раствора, полученного путем смешивания 20 мл раствора азотистой кислоты с молярной концентрацией эквивалента 0,05 моль/л и 30 мл раствора нитрита калия молярной концентрацией эквивалента 1,5 моль/л, если рКа = 3,29.
|
|
|
6. Вычислите рН раствора, содержащего по 0,5 моль эквивалента гидроксида аммония и хлорида аммония, рК (NH4OH) = 4,75. Как изменится рН при добавлении к одному литру этого раствора
· 0,1 моль эквивалента КOH;
· 0,1 моль эквивалента HCl;
· при разбавлении водой в 10 раз?
7. Каково соотношение количества вещества уксусной кислоты и ацетата калия в буферном растворе с рН = 4,75, если рК(CH3COOH) = 4,75.
8. Сколько миллилитров раствора NH4Cl с молярной концентрацией эквивалента 0,5 моль/л следует прибавить к 100 мл раствора NH4OH с молярной концентрацией эквивалента 0,2 моль/л, чтобы получить буферную систему с рН= 9,25, если рК (NH4OH) = 4,75.
9. Определите рН раствора, полученного при смешивании 50 мл раствора дигидрофосфата калия с молярной концентрацией эквивалента 0,1 моль/л и 15 мл раствора гидрофосфата калия с молярной концентрацией эквивалента 0,2 моль/л, если рК(H2PO4-) = 7,21. Приведите механизм действия данной буферной системы.
10. К 2 мл раствора уксусной кислоты с молярной концентрацией эквивалента 0,4 моль/л добавили 3 мл раствора гидроксида натрия с молярной концентрацией эквивалента 0,2 моль/л. Вычислить концентрацию протонов и рН полученной смеси.
11. Рассчитайте буферную емкость аммиачного буфера, если при добавлении 0,001 моль эквивалента HCl к 100 мл этого раствора значение его рН уменьшилось на 0,09.
12. Составьте конспект для ответа по вопросам:
А) Роль буферных растворов в организме человека.
Б) Роль гидрокарбонатного буферного раствора при поддержании постоянства рН крови, нарушаемого процессами дыхания.
|
|
|


