 |
Тепловое движение. Абсолютная температура – как мера средней кинетической энергии.
|
|
|
|
1. Тепловое движение молекул
Поведение газов можно охарактеризовать несколькими величинами, которые относятся не к отдельным молекулам, а ко всем сразу. Это объем (V); давление (Р) и температура (Т). Их называют термодинамическими.
Измерять температуру научились очень давно, еще до того, как поняли, что же это такое. Все мы знаем отличие между холодными телами и горячими. На ощупь мы уверенно можем определить, какое тело нагрето сильнее, и говорим, что это тело имеет более высокую температуру. Следовательно, температура характеризует степень нагретости тела.
Но необходимо иметь прибор, позволяющий измерять температуру тела. Метод измерения температур основан на установлении теплового равновесия между телами при их контакте. Мы знаем, что при соприкосновении двух
различно нагретых тел они обмениваются энергией, т.е. более горячее тело отдает свое тепло более холодному телу. Это происходит до тех пор, пока температуры тел не станут одинаковыми. В этом случае говорят, что тела находятся в тепловом равновесии.
Измеряют температуру термометром. Для измерения температуры используют зависимость объема жидкости от ее температуры. За 00 С берут температуру таяния льда, за 1000 – кипения воды. Установленную таким образом температурную шкалу называют шкалой Цельсия, по имени шведского астронома А. Цельсия, предложившего ее. Проградуированный таким способом термометр можно применять для измерения температуры, приводя его в тепловое равновесие с тем телом, температура которого интересует.
В физике широко распространена термодинамическая шкала температур, которую предложил Английский ученый Кельвин.

|
|
|
Шкала Кельвина шкала Цельсия
Температуру, отсчитываемую по термодинамической шкале называют абсолютной:
Т=t+273 [К]
Температуру, равную 0 К, называют абсолютным нулем, ему соответствует - 273 0 С.
2. Абсолютная температура – как мера средней кинетической энергии.
Температура тела связана со скоростью движения молекул. Чем выше температура тела, тем быстрее движутся его молекулы, а следовательно, тем больше их кинетическая энергия.
Абсолютную температуру можно считать мерой средней кинетической энергии движения молекул.
Е=  kТ,
kТ,
где Т – термодинамическая температура [K],
k – постоянная Больцмана k=1,38 ·10-23 Дж/К
Выясним зависимость давления газа от концентрации молекул и температуры.
Р=  n Е и Е=
n Е и Е=  k Т
k Т 
Р= nkТ
Давление газа не зависит от его природы, а определяется только концентрацией молекул и температурой газа.
При изучении свойств газов экспериментально было установлено, что один моль любого газа при нормальных условиях имеет объем 22,4ּ10-3 м3 или 22,4 л. Этот результат опытов находится в полном соответствии с
известным из химии законом Авогадро: в равных объемах различных газов при одинаковых давлениях и температурах содержится одинаковое число молекул.
3. Скорость движения молекул
Молекулы газа непрерывно хаотически движутся. Проследить за движением каждой молекулы невозможно, т.к. они движется по различным траекториям и с различными скоростями. Выведем формулу для вычисления средней квадратичной скорости молекул:
Е=  k Т и Ек =
k Т и Ек = 
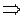
 k Т =
k Т = 
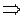
3 kT = m0 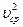
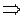
|
|
|
 =
= 
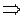
 =
= 
 Вычисляя по этой формуле скорости молекул, получили, что скорость молекулы азота равна 500 м/с, водорода – 1800 м/с. Физики были ошеломлены, т.к. скорости молекул оказались большими, чем скорости артиллерийских снарядов. Но ведь известно, что например запахи в газе распространяются довольно медленно. Но это объяснили тем, что траектория движения каждой молекулы представляет собой
Вычисляя по этой формуле скорости молекул, получили, что скорость молекулы азота равна 500 м/с, водорода – 1800 м/с. Физики были ошеломлены, т.к. скорости молекул оказались большими, чем скорости артиллерийских снарядов. Но ведь известно, что например запахи в газе распространяются довольно медленно. Но это объяснили тем, что траектория движения каждой молекулы представляет собой
запутанную ломаную линию. При перемещении молекулы из точки А в точку В пройденный ею путь оказывается гораздо большим, чем расстояние АВ.
Вопросы для самоконтроля и повторения
1. Какую температуру называют термодинамической?
2. Как вычислить термодинамическую температуру?
3. Что называют абсолютным нулем?
4. Как вычислить кинетическую энергию движения молекул?
5. Чему равна постоянная Больцмана?
6. От чего зависит давление газа?
7. Сформулируйте закон Авогадро.
8. Как вычислить скорость движения молекул газа?
Тема
Уравнение состояния идеального газа. Газовые законы.
1. Уравнение состояния идеального газа.
Из основного уравнения МКТ: Р=  nЕк n=
nЕк n= 
Р=  ·
·  ·Е
·Е  =
=  · Е
· Е
Следовательно, величина Р ·  - пропорциональна температуре:
- пропорциональна температуре:
Р ·  = kT,
= kT,
Так как PV = NkT и N= 
 РV=
РV=  кT,
кT,
Обозначим величину кNА через R – универсальная газовая постоянная R = 8,31  ,
,
Тогда РV =  ·RT – уравнение Клапейрона-Менделеева
·RT – уравнение Клапейрона-Менделеева
Оно связывает основные термодинамические величины: Р,V,Т.
2. Объединенный газовый закон.
Обозначим параметры: 1-го состояния газа - Р1, V1, Т1,
а 2-го состояния - Р2, V2,Т2.,
то  =
=  · R и
· R и  =
=  · R следовательно,
· R следовательно,  =
= 
или 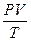 = Соnst - объединенный газовый закон:
= Соnst - объединенный газовый закон:
при постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина постоянная.
3. Газовые законы.
Изменение одного из термодинамических параметров – давления, объема, температуры – вызывает изменение остальных параметров. Эту зависимость называют газовыми законами или изопроцессам.
 Процессы, при которых масса газа и один из его параметров остаются постоянными, называются изопроцессами (от греческого слова «изос» - равный, одинаковый). Поскольку имеется три параметра газа: давление, температура и объем, существуют три различных изопроцесса: изотермический, изохорный, изобарный.
Процессы, при которых масса газа и один из его параметров остаются постоянными, называются изопроцессами (от греческого слова «изос» - равный, одинаковый). Поскольку имеется три параметра газа: давление, температура и объем, существуют три различных изопроцесса: изотермический, изохорный, изобарный.
|
|
|
1). Первый газовый закон был открыт английским ученым Бойлем
в 1660 г. и несколько позднее, французский физик Мариотт пришел к тем же выводам. Закон получил название закона Бойля – Мариотта. Процесс изменения состояния системы при постоянной температуре называется изотермическим. Произведение давления данной массы газа на его объем при неизменной температуре есть величина постоянная
p1V1 = p2V2 или
pV = Const при T = Const

Зависимость давления газа от объема можно изобразить графически с помощью кривой, которая носит название изотерма. Она выражает обратно пропорциональную зависимость между давлением и объемом.
Устанавливаемую законом Бойля – Мариотта зависимость давления от объема можно проверить с помощью прибора, изображенного на рисунке. Гофрированный сосуд соединен с манометром М, регистрирующим давление внутри сосуда. При вращении винта В объем сосуда меняется. Меняя объем сосуда можно убедиться в справедливости закона.
2). Закон, устанавливающий зависимость объема газа от температуры при постоянном давлении, был открыт французским ученым Гей-Люссаком. Процесс изменения состояния системы при постоянном давлении называется
изобарным. Отношение объема данной массы газа к его температуре при постоянном давлении есть величина постоянная.

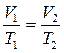 или
или
 = Const при р = Const
= Const при р = Const
 Зависимость объема газа от температуры можно изобразить графически с помощью кривой, которая носит название изобара. Она выражает прямо пропорциональную зависимость между объемом и температурой.
Зависимость объема газа от температуры можно изобразить графически с помощью кривой, которая носит название изобара. Она выражает прямо пропорциональную зависимость между объемом и температурой.
Устанавливаемую законом Гей – Люссаком зависимость объема от температуры можно проверить с помощью прибора, изображенного на рисунке. Колба с газом помещается в сосуд с водой и льдом. В пробку вставлена трубка, изогнутая таким образом, что свободный конец ее горизонтален. Газ в колбе отделен от окружающего воздуха небольшим столбиком ртути в трубке. Температуру газа определяют по термометру, а объем по положению столбика ртути. Сначала по положению столбика ртути 1 определяют объем газа при 00С. Затем газ нагревают – столбик ртути перемещается в положение 2.
|
|
|
3). Закон, устанавливающий зависимость давления газа от температуры при постоянном объеме, был открыт французским ученым Шарлем в 1787 г. Процесс изменения
состояния системы при постоянном объеме называется изохорным. Отношение давления данной массы газа к его температуре при постоянном объеме есть величина постоянная.

 или
или
 = Const при V = Const
= Const при V = Const
 Зависимость давления газа от температуры можно изобразить графически с помощью кривой, которая носит название изохора. Она выражает прямо пропорциональную зависимость между давлением и температурой.
Зависимость давления газа от температуры можно изобразить графически с помощью кривой, которая носит название изохора. Она выражает прямо пропорциональную зависимость между давлением и температурой.
Устанавливаемую законом Шарля зависимость давления от температуры можно проверить с помощью прибора, изображенного на рисунке. Гофрированный сосуд соединен с манометром, регистрирующим давление внутри сосуда. При опускании сосуда сначала в холодную, а потом в горячую можно убедиться в справедливости закона.
Вопросы для самоконтроля и повторения
1. Сформулируйте зависимость идеального газа от температуры.
2. Сформулируйте уравнение Клапейрона-Менделеева.
3. Чему равна универсальная газовая постоянная?
4. Что называется изопроцессами?
5. Сформулируйте изотермический закон.
6. Сформулируйте изобарный закон.
7. Сформулируйте изохорный закон.
Тема:
Модель строения жидкости. Насыщенный и ненасыщенный пары. Влажность воздуха.
1. Испарение и конденсация
Все вещества в природе могут находиться в 3-х агрегатных состояниях: твердом, жидком и газообразном. МКТ объясняет почему вещества могут переходить из одного агрегатного состояния в другое.
Например: количество жидкости в открытом сосуде уменьшается, мы говорим жидкость испаряется. Почему? Молекулы жидкости движутся. Обладают некоторой кинетической энергией. Одни – большей, другие – меньшей. Те молекулы, которые обладают большей кинетической энергией могут преодолеть силы притяжения других молекул и вырваться с поверхности жидкости. Так происходит процесс испарения.
Наряду с испарением происходит конденсация – обратный процесс, когда молекулы возвращаются обратно жидкость.
Испарение зависит от температуры жидкости: чем выше температура, тем большее количество молекул испаряется с поверхности жидкости.
2. Насыщенный пар.
Если сосуд с жидкостью закрыть крышкой, то количество жидкости сначала будет уменьшаться, но через некоторое время ее убыль прекратится. При неизменной температуре система жидкость-пар придет в состояние теплового равновесия и будет находиться в нем сколь угодно долго. Мы здесь говорим пар, а не газ, т.к. при определенных условиях свойства газа зависят от его рода, в таких условиях газ называют паром. В этом состоянии одновременно с процессом испарения происходит процесс конденсации. Через некоторое время число испаряющихся молекул в закрытом сосуде станет равно числу возвращающихся в жидкость молекул. Между жидкостью и паром установилось динамическое равновесие.
|
|
|
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром, т.е. в данном сосуде над жидкостью не может находиться большее количество пара.
3. Давление насыщенного пара.
|
|
|


