 |
Внутренняя энергия и работа газа.
|
|
|
|
1. Внутренняя энергия газа
Мы начинаем изучение термодинамики – теории тепловых процессов, в которой не учитывается молекулярное строение тел.
Термодинамика была создана в середине XIX в., после открытия закона сохранения энергии. В ее основе лежит понятие внутренняя энергия.
В XIX в. было доказано, что наряду с механической энергией макроскопические тела обладают еще и энергией, заключенной внутри самих тел. Это внутренняя энергия.
Мы рассматривали опыт с шариком, когда при падении шарика потенциальная энергия уменьшалась, а кинетическая увеличивалась. Но после падения шарика механическая энергия (и потенциальная, и кинетическая) исчезает, но она не просто исчезает, а передается движущимся молекулам шарика и стола. Интенсивность движения молекул возрастает и тела нагреваются. Это означает изменение внутренней энергии тел.
Существует и обратный процесс, т.е. переход внутренней энергии в механическую. Если нагреть пробирку с водой закрытую пробкой, то пробка вылетит. При нагревании воды ее внутренняя энергия увеличивается и давление пара выбьет пробку
Внутренняя энергия макроскопического тела равна сумме кинетической энергии движения молекул тела и потенциальной энергии взаимодействия молекул друг с другом.
Внутреннюю энергию тела вычислить практически невозможно из-за за огромного числа движущихся и взаимодействующих молекул.
Наиболее просто вычислить внутреннюю энергию идеального одноатомного газа, т.к. она представляет собой кинетическую энергию хаотического теплового движения его молекул, их потенциальная энергия считается равной нулю, т.к. молекулы идеального газа не взаимодействуют друг с другом.
|
|
|
Вычислим внутреннюю энергию идеального одноатомного газа:
Е= 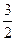 kT – одного атома N=
kT – одного атома N=  NА
NА
Тогда
U = Е · N =  kT ·
kT ·  NА=
NА=  RT ·
RT · 
U= 
 RT
RT
Изменение внутренней энергии вычисляется по формуле:
∆U= 
 R∆T
R∆T
Для идеальных газов внутренняя энергия зависит только от температуры.
Для реальных газов внутренняя энергия определяется как кинетической, так и потенциальной энергией взаимодействия частиц, т.к. в реальных газах атомы и молекулы взаимодействуют друг с другом. Следовательно, внутренняя энергия зависит еще и от объема, т.к. при изменении объема, меняется расстояние между молекулами.
2. Работа
Внутренняя энергия тела может меняться в результате теплопередачи и при совершении работы над системой или системы над внешними телами.
А = F ∙ S
F = p ∙ s, где р – давление газа,
s – площадь поверхности поршня.
S = Δh = h2 – h1
Тогда A = p ∙ s ∙ Δh = p ∙ s (h2 – h1) = p (s h2 – s h1) = pV2 – pV1
 Работа равна А= р ΔV
Работа равна А= р ΔV
Газ находится в сосуде, поршень опускают, при этом совершают работу над газом. Внутренняя энергия газа меняется – увеличивается. Так как при движении поршня навстречу молекулам газа он сталкивается с ними и передает им часть своей энергии и скорость движения молекул увеличивается. Следовательно, увеличивается внутренняя энергия.
При сжатии газа: работа отрицательна, т.к.
 ΔV= V2 – V1 < 0 A= - p ΔV
ΔV= V2 – V1 < 0 A= - p ΔV
Когда поршень поднимается вверх, внутренняя энергия уменьшается. Т.к. при столкновении молекул с удаляющимся поршнем скорость их уменьшается и внутренняя энергия уменьшается.
При расширении газ совершает положительную работу, т.к.
ΔV= V2 – V1 > 0 A΄ = p ΔV
A= - A΄ = - p ΔV
3. Теплопередача
Изменить внутреннюю энергию можно не только совершая работу, но и нагревая тело, т.е. путем теплопередачи.
|
|
|
Процесс передачи энергии от одного тела к другому без совершения работы называется теплопередачей. А энергию, переданную телу в результате теплопередачи, называется количеством теплоты.
1) Количество теплоты необходимое для нагревания тела:
Q = сm Δt, c – удельная теплоемкость [  ]
]
2) Количество теплоты необходимое для плавления
Q = λ m, λ – удельная теплота плавления [  ]
]
3) Количество теплоты необходимое для парообразования
Q= r m, r – удельная теплота парообразования [  ]
]
Вопросы для самоконтроля и повторения
1. Что называется внутренней энергией тела?
2. Как вычислить внутреннюю энергию тела?
3. Как можно изменить внутреннюю энергию тела?
4. Что такое теплопередача?
5. Как вычислить работу системы?
Тема:
Первое начало термодинамики. Необратимость тепловых процессов.
1. Первое начало термодинамики.
Для тепловых явлений закон сохранения энергии тоже справедлив, но здесь он получил название первого закона термодинамики:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты переданного системе:
ΔU = A+ Q
Если система совершает работу над внешними телами, то подводимое к системе количество теплоты идет на увеличение ее внутренней энергии и на совершение работы над внешними телами
Q = ΔU + А΄
На основании 1 начала термодинамики составляется уравнение теплового баланса по которому ведутся все тепловые расчеты.
При теплообмене сумма количеств теплоты отданных всеми телами, внутренняя энергия которых уменьшается и равна сумме количеств теплоты полученных всеми телами, внутренняя энергия которых увеличивается


2. Применение первого начала термодинамики к изопроцессам.
Рассмотрим применение 1 начала термодинамики к изопроцессам.
1) Изотермический процесс: Т= Const  внутренняя энергия не меняется, т.е. ΔU = 0
внутренняя энергия не меняется, т.е. ΔU = 0
Тогда первое начало термодинамики Q = ΔU + А΄ будет иметь вид
Q = A΄
Если газ получает теплоту, то совершает положительную работу; если газ отдает теплоту, то совершает отрицательную работу.
2) Изохорный процесс: V= Const  ΔV = 0, следовательно А = 0
ΔV = 0, следовательно А = 0
Тогда первое начало термодинамики ΔU = A+ Q будет иметь вид
|
|
|
ΔU = Q
Если газ нагревается, то внутренняя энергия увеличивается; если газ охлаждается, то внутренняя энергия уменьшается.
3) Изобарный процесс: р= Сonst
Тогда первое начало термодинамики будет иметь вид
Q= ΔU + A΄
т.е. количество теплоты, переданное телу идет на изменение его внутренней энергии и на совершение им работы.
4) Адиабатный процесс – это процесс, который происходит в системе, которая не обменивается теплотой с окружающими телами (т.е. теплоизолированной системе).
Q = 0
Тогда первое начало термодинамики ΔU = A+ Q будет иметь вид
ΔU = А,
т.е. изменение внутренней энергии происходит за счет совершения работы.
3. Необратимость тепловых процессов.
Закон сохранения энергии утверждает, что количество энергии при любых ее превращениях остается неизменным. Но он ничего не говорит о том, какие превращения возможны. А между тем, многие процессы, вполне допустимые с точки зрения закона сохранения энергии в действительности никогда не происходят.
1) Пример: в стакан с горячим чаем опускают холодную ложку, она нагревается, т.е. тепло переходит от горячего чая к холодной ложке. Противоположного процесса, т.е. перехода тепла от ложки нет.
Вывод: теплота может переходить только от более горячего тела к более холодному. Обратный процесс, хотя и не противоречит закону сохранения энергии – не происходит.
2) Пример: колебания маятника, выведенного из положения равновесия, затухают, т.к. из-за сопротивления воздуха, механическая энергия убывает, а температура шара и воздуха повышается. А вот обратный процесс - увеличение амплитуды колебаний маятника за счет уменьшения внутренней энергии шара не происходит.
Вывод: механическая энергия может самопроизвольно переходить во внутреннюю, а внутренняя в механическую не может.
Следовательно, пример перехода тепла от горячего тела к холодному, механической энергии во внутреннюю – примеры необратимых процессов.
4. Понятие о втором начале термодинамики.
Эти примеры говорят о том, что все процессы в природе имеют определенную направленность. Исходя из этого, немецкий ученый Клаузиус сформулировал второй закон термодинамики:
|
|
|
Невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других изменений в обеих системах или в окружающих телах.
Вопросы для самоконтроля и повторения
1. Сформулируйте первое начало термодинамики.
2. Какое утверждение содержится во втором начале термодинамики?
Тема:
Тепловые двигатели и охрана окружающей среды. КПД тепловых двигателей.
Запасы внутренней энергии земной коре и океанах не ограничены. Но необходимо их использовать, т.е. создать такие устройства, которые бы внутреннюю энергию превращали в механическую.
Этими устройствами являются тепловые двигатели.

А΄ = |Q1| - |Q2|
КПД называется отношение работы А΄, совершенной двигателем, к количеству теплоты, полученному от нагревателя:
ή=  =
=  = 1 -
= 1 - 
 ή < 1
ή < 1
В 1824 г. французский ученый Карно установил, что максимальное КПД тепловой машины зависит от соотношения температур рабочего тела и холодильника.
ή = 
Вопросы для самоконтроля и повторения
1. Расскажите об устройстве тепловых двигателей.
2. Что называется КПД теплового двигателя?
|
|
|


