 |
РНК-полимеразы эукариот I, II, III. Участие разных полимераз в транскрипции разных клеточных РНК.
|
|
|
|
Типы РНК:
1. Рибосомальная РНК (rRNA)
2. Транспортная РНК (tRNA)
3. 5S РНК (5S RNA)
4. Малые ядерные РНК (snoRNA)
5. Информационная РНК (mRNA)
Эукариоты имеют три типа РНК-полимераз:
1. РНК-полимераза I – осуществляет только транскрипцию рибососмальной РНК.
2. РНК-полимераза II – осуществляет транскрипцию большинства генов
3. РНК-полимераза III – осуществляет синтез транспортной РНК, 5S-рибосомального гена и малых ядерных РНК.
Структурно сходны друг с другом и имеют некоторые общие субъединицы, тогда как другие субъединицы являются уникальными. Каждая из этих РНК-полимераз, полагают, содержит 10 или более полипептидных цепей. РНК-полимеразы эукариот и бактерий эволюционно родственны. РНК-полимеразы I, II и III отличаются по чувствительности к токсину альфа-аманитину: РНК-полимераза I не чувствительна к нему; РНК-полимераза II очень чувствительна; РНК-полимераза III умеренно чувствительна. РНК- полимераза II транскрибирует гены, РНК-продукты которых будут транслированы в белки. Другие две РНК-полимеразы синтезируют РНК, которые выполняют структурные или каталитические роли, в основном, как часть белок-синтезирующего аппарата.
11.Инициация транскрипции РНК полимеразой II эукариот. Для правильной инициации транскрипции РНК полимеразой II в зоне корового элемента промотора должны собраться соответствующие инициаторные факторы, называемые TFII (Transcription Factors of RNA polymerase II). Среди них: TFIIA, TFIIB, TFIID, TFIIE, TFIIF и TFIIH. Из вышеупомянутых факторов лишь TFIID способен напрямую взаимодействовать с промоторной областью ДНК, остальные факторы удерживаются в промоторной области посредством белок-белковых взаимодействий друг с другом и с TFIID.
Специфическое связывание TFIID с ДНК является начальным этапом инициации транскрипции. В основе этого события лежит специфическое взаимодействие ТАТА - связывающего компонента TFIID (TBP - TATA Binding Protein) с соответствующим участком ДНК.
|
|
|
Связывание TBP с ТАТА-боксом запускает каскад событий, приводящий к формированию преинициаторного комплекса: с TBP-TATA комплексом связывается инициаторный фактор TFIIB, с TFIIB связывается преформированный комплекс полимеразы II с инициаторным фактором TFIIF. Считается, что таким образом реализуется одна из функций TFIIB, состоящая в правильном позиционировании полимеразы относительно промотора. С TFIIF связывается инициаторный фактор TFIIE, с TFIIE связывается фактор TFIIH. На этом формирование преинициаторного комплекса заканчивается.
В преинициаторном комплексе TFIIH проявляет киназную активность - фосфорилирует С - концевой домен большой субъединицы РНК полимеразы II. Тем временем хеликаза АТФ - зависимо расплетает двойную спираль ДНК в районе старта транскрипции. Формируется так называемый "открытый" комплекс. Полимераза уходит с промотора и начинает элонгацию. После ухода полимеразы TFIID остаётся связанным с коровым элементом промотора в течение некоторого времени и может принять участие в новом раунде инициации. После терминации транскрипции специальная фосфатаза возвращает большую субъединицу полимеразы в дефосфорилированное состояние. Таким образом восстанавливается способность полимеразы инициировать транскрипцию. Существуют две модели инициации транскрипции РНК-полимеразой II. В соответствии с одной из них на промоторе происходит постепенная (ступенчатая) сборка инициационного комплекса из отдельных компонентов. Другая модель акцентирует внимание на то, что Pol II может входить в состав инициационного комплекса в виде холофермента, состоящего из многих субъединиц. Сборка такого комплекса начинается с последовательного связывания с промотором основных факторов транскрипции. Инициация транскрипции с промоторов класса II регулируется на уровне сборки мультибелкового преинициаторного комплекса в районе промотора.
|
|
|
Одной из форм регуляции является взаимодействие базальных компонентов преинициаторного комплекса с белками - активаторами, связанными с проксимальными или дистальными элементами промотора.
Другая форма регуляции - посредством прямого связывания соответствующих активаторов с компонентами преинициаторного комплекса. Например, TBP - ассоциированные факторы (TAF's), входящие в состав TFIID, являются мишенью для ген-специфических активаторов транскрипции таких как p53, NF kappa B, эстрогеновый рецептор и другие.
В регуляции инициации также принимают участие белки, называемые non-TAF коактиваторами. Примером такого рода служит дрожжевой белок GCN5. Эти белки играют роль адаптеров между активаторами и факторами, входящими в состав преинициаторного комплекса.
Разнообразные регуляторные взаимодействия имеют место и между самими факторами инициации транскрипции. Например, отмечены взаимодействия между dTAF42 (а также его человеческим гомологом hTAF31) и фактором инициации TFIIB. Показано, что hTAF80 взаимодействует с TFIIF. Вероятно, роль подобных взаимодействий состоит в том, чтобы дополнительно стабилизировать преинициаторный комплекс и облегчить привлечение последующих факторов.
Существует минимальный набор белков, достаточный для того, чтобы инициировать транскрипцию с промотора класса II in vitro. Это - перечисленные выше основные компоненты преинициаторного комплекса. Однако, вышеупомянутые белки способны обеспечить довольно низкий уровень транскрипции, называемый базальным. Причиной подобного эффекта принято считать препятствия, возникающие in vivo в виде негативных регуляторов инициации транскрипции, структуры хроматина и так далее. Считается, что в клетке такого рода препятствия преодолеваются с помощью активаторов транскрипции, взаимодействующих как с ДНК в районе промотора, так и с базальными факторами, входящими в состав преинициаторного комплекса.
 Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимеразой. Факторы инициации вызывают изменение конформации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т.е. образуется транскрипционная вилка,
Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимеразой. Факторы инициации вызывают изменение конформации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т.е. образуется транскрипционная вилка,
|
|
|
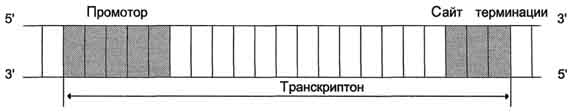
12.Кэпирование, сплайсинг и полиаденилирование транскрпитов,синтезируемых полимеразой II. У эукариот молекула РНК модифицируется после транскрипции. По окончании транскрипции бактериальных р-РНК и т-РНК, они могут быть сразу использованы в трансляции. Никаких дополнительных изменений в структуре этих молекул не происходит. Трансляция бактериальных иРНК может начинаться даже до окончания транскрипции. Это связано с отсутствием границ между ядром и цитоплазмой. Способность инициировать трансляцию прокариотических РНК, до завершения транскрипции, предоставляет уникальную возможность регуляции транскрипции некоторых генов. Еще одна особенность бактериальных иРНК – они полицистронны. Это означает, что один транскрипт является копией нескольких структурных генов У эукариот иРНК –копия одного гена.В отличие от прокариот все типы эукариотических РНК подвергаются значительной посттранскрипционной модификации (процессингу).Вся совокупность ядерных транскриптов РНК-полимеразы II известна как гетерогенная ядерная РНК (гяРНК), поскольку одна из основных характеристик, отличающих эту фракцию ядерных РНК - это чрезвычайно высокая вариабельность размеров входящих в нее транскриптов.
По мере синтеза эти транскрипты ковалентно модифицируются по 5'-концам и 3'-концам таким образом, что они становятся отличными от транскриптов, синтезированных другими РНК-полимеразами. Эти модификации будут позже использованы в цитоплазме как сигналы того, что данные информационные РНК должны быть транслированы в белки. Все 3 класса РНК транскрибируются с генов, которые содержат интроны. Последовательности, кодируемые интронами ДНК, должны быть удалены из первичного транскрипта до того, как РНК станет биологически активной. Процесс удаления копий интронных последовательностей получил название сплайсинга РНК.В дополнение сплайсингу, у и-РНК происходит модификация 3’и 5’ концов. К 5 ' концу всех эукариотических иРНК (который синтезируется первым в процессе транскрипции) присоединяется во время процессинга остаток 7-метилгуанозина с образованием уникальной 5 'à 5 ' фосфодиэфирной связи. Этот дополнительный нуклеотид получил название кэпировуание или колпачек. Кэпирование происходит еще до завершения синтеза всей молекулы. Образующаяся структура на 5’ конце иРНК защищает РНК от экзонуклеаз и, что не менее важно, ответственна за последующее связывание молекулы мРНК с рибосомой.
|
|
|
Схема полиаденилирования иРНК

Сразу после завершения транскрипции или после специфического расщепления в определенном месте растущей цепи РНК происходит полиаденилирование. Оно заключается в том, что специальный фермент - полиаденилатполимераза присоединяет к 3'-концу каждого РНК-транскрипта, которому суждено стать молекулой мРНК, от 20 до 250 остатков адениловой кислоты (поли(А)), что и завершает процесс образования первичного РНК-транскрипта. Полиаденилатполимераза узнает специфическую последовательность AAУAAA. Этот фермент, обладающий несколькими активностями отщепляет от первичного транскрипта небольшрй фрагмент в 11-30 нуклеотидов и затем присоединяет поли(А) последовательность Функции этой последовательности неизвестны. Принято считать, что такой "хвост" способствует последующему процессингу РНК и экспорту зрелых молекул мРНК из ядра. Процессы 5'-кэпирования и 3'- полиаденилирования характерны только для транскриптов, синтезируемых РНК-полимеразой II. Это можно объяснить специфическим взаимодействием ферментов, катализирующие эти процессы с РНК-полимеразой II, но не взаимодействующих с РНК-полимеразами I и III. Необходимость маркировать подобным образом концы молекул-предшественников и-РНК может служить объяснением, почему эти молекулы синтезируются специальной РНК-полимеразой.
13. Синтез белка
В пятидесятых годах XX века было установлено, что синтез белка происходит в рибонуклеопротеиновых частицах, называющихся рибосомами. Диаметр рибосомы бактерии E. coli составляет 18 нм, а их общее количество – десятки тысяч в клетке. Рибосомы эукариот несколько крупнее (21 нм). Сам процесс протекает в пять этапов.
1.Активация аминокислот. Каждая из 20 аминокислот белка соединяется ковалентными связями к определённой т-РНК, используя энергию АТФ. Реакция катализуется специализированными ферментами, требующими присутствия ионов магния.
2.Инициация белковой цепи. и-РНК, содержащая информацию о данном белке, связывается с малой частицей рибосомы и с инициирующей аминокислотой, прикреплённой к соответствующей т-РНК. т-РНК комплементарна с находящимся в составе и-РНК триплетом, сигнализирующим о начале белковой цепи.
|
|
|
3.Элонгация. Полипептидная цепь удлиняется за счёт последовательного присоединения аминокислот, каждая из которых доставляется к рибосоме и встраивается в определённое положение при помощи соответствующей т-РНК. В настоящее время генетический код полностью расшифрован, то есть всем аминокислотам поставлены в соответствие триплеты нуклеотидов. Элонгация осуществляется при помощи белков цитозоля (так называемые факторы элонгации).
4.Терминация. После завершения синтеза цепи, о чём сигнализирует ещё один специальный кодон и-РНК, полипептид высвобождается из рибосомы.
5.Сворачивание и процессинг. Чтобы принять обычную форму, белок должен свернуться, образуя при этом определённую пространственную конфигурацию. До или после сворачивания полипептид может претерпевать процессинг, осуществляющийся ферментами и заключающийся в удалении лишних аминокислот, присоединении фосфатных, метильных и других групп и т. п.
Генетический код - это система записи информации о последовательности расположения аминокислот в белках с помощью последовательности расположения нуклеотидов в ДНК.
Поскольку ДНК непосредственного участия в синтезе белка не принимает, то код записывается на языке РНК. В РНК вместо тимина входит урацил.
Открытая рамка считывания — последовательность нуклеотидов в составе ДНК или РНК, потенциально способная кодировать белок. Основным параметром наличия OРС служит отсутствие стоп-кодонов.
Закрытая рамка считывания — рамка считывания, внутри которой в результате мутации возникает стоп-кодон.
Кодо́н (кодирующий тринуклеотид) — единица генетического кода, тройка нуклеотидных остатков (триплет) в ДНК или РНК, обычно кодирующих включение одной аминокислоты. Последовательность кодонов в гене определяет последовательность аминокислот в полипептиднойтцепи белка, кодируемого этим геном.
Антикодо́н — триплет (тринуклеотид), участок в транспортной рибонуклеиновой кислоте (тРНК), который спаривается с кодоном матричной РНК (мРНК) и обеспечивает включение соответствующего аминокислотного остатка в белок в процессе трансляции.
Строение рибосомы: Рибосомы прокариотических и эукариотических организмов различаются по размерам. У эукариот они представлены 80S частицами, тогда как коэффициент седиментации рибосом прокариот составляет 70S.
Рибосомы всех известных организмов построены из двух неравных субчастиц: прокариотические - 30S и 50S, а эукариотические - 40S и 60S. 70S рибосомы эубактерий в своем составе содержат 55-60 рибосомных белков, для 80S рибосом эукариот это число составляет 75-85. В обоих случаях рибосомные белки в составе рибосом ассоциированы с молекулами рРНК, образуя пространственно организованные рибонуклеопротеиновые тяжи.
14.
Рестриктазы — группа бактериальных нуклеаз, специфически расщепляющих ДНК.
Типы рестриктаз:
1. Рестриктаза первого типа (например, ЕсоК из Escherichia coli К12) узнает определённую последовательность нуклеотидов и разрезает двухцепочную молекулу ДНК неподалёку от этой последовательности в произвольной точке и само место разреза не строго специально (по-видимому, после образования комплекса с ДНК фермент неспецифически взаимодействует с удаленной областью ДНК или передвигается вдоль нити ДНК).
2. Рестриктаза второго типа (например, EcoRI) узнает определённую последовательность и разрезает двойную спираль ДНК в определённой фиксированной точке внутри этой последовательности. Рестриктазы этого типа узнают палиндромальные последовательности, которые обладают центральной осью и считываются одинаково в обе стороны от оси симметрии.
3. Рестриктаза третьего промежуточного типа (например, EcoPI) узнает нужную последовательность и разрезает двухцепочную молекулу ДНК, отступив определённое число нуклеотидных пар от её конца (или в нескольких точках на разном удалении от сайта узнавания). При этом образуются фрагменты ДНК либо с ровными (тупыми) концами, либо с выступающими (липкими) 5'- или 3'-концами. Эта рестриктаза узнает асимметричные сайты.
Сайт рестрикции [англ. site — участок, местоположение; лат. restrictio — ограничение] — короткая нуклеотидная последовательность в молекуле ДНК (обычно 4—8 п.н.), узнаваемая рестриктазой, которая определяет место расщепления данным ферментом.
Биолог.роль систем рестрикции: защита клетки от чужеродного генетического материала, например, бактериофагов и плазмид; Защитная функция систем основана на их способности взаимодействовать с сайтами узнавания и различать их метилированное и неметилированное состояние.
Рестрикционной или физической картой называют схему, на которую нанесены сайты узнавания разных рестриктаз, дана линейная последовательность этих сайтов и расстояние между ними в парах нуклеотидов. Для составления рестрикционной карты используют методы: последовательного расщепления ДНК двумя рестриктазами, частичное расщепление ДНК, меченой радиоактивной меткой по определенному концу и др. Для примера рассмотрим способ построения рестрикционной карты путем последовательного расщепления ДНК двумя рестриктазами. При этом способе сначала определяют величины фрагментов, образуемых под действием одной рестриктазы (I). Затем полученные фрагменты обрабатывают другой рестриктазой (II). И наоборот, фрагменты, полученные под действием рестриктазы II, обрабатывают рестриктазой I. На основе логического анализа, сопоставляя размеры фрагментов, образовавшихся после этих расщеплений, строят рестрикционные карты линейной или кольцевой ДНК.
|
|
|


