 |
Определение восстановителей
|
|
|
|
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ, КОМПЛЕКСОНОМЕТРИЧЕСКОЕ И ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ
1. Перманганатометрия.
2. Индикаторы в окислительно-восстановительном титровании.
3. Иодометрия.
4. Комплексонометрия.
5. Аргентометрия.
Окислительно-восстановительное титрование основано на использовании в качестве титрантов растворов окислителей или восстановителей, вступающих в редоксреакции с определяемым веществом. Классифицируют методы окислительно-восстановительного титрования по веществам, используемым в качестве титрантов. Например, если титрант перманганат калия – перманганатометрия, дихромат калия – дихроматометрия, ванадат аммония – ванадатометрия и т.д. Определяют редоксиметрией окислители, восстановители, в отдельных случаях можно определить вещества, не вступающие в реакции окисления-восстановления.
Рассмотрим некоторые из этих методов.
Перманганатометрия
Перманганатометрический метод анализа основан на реакциях перманганата калия с восстановителями.
Титрование проводят как в кислой, так и в нейтральной и щелочной среде.
кислая среда MnO4¯+8H+ +5e ↔ Mn2++4H2O E° =1,51 В
нейтральная или слабо щелочная MnO4¯+4H+ +3e ↔ MnO2↓+2H2O
E° =1,67 В
MnO4¯+2H2O +3e ↔ MnO2↓+4OH− E° =0,60 В
сильно щелочная MnO4¯+e ↔ MnO42– E° = 0,61 В
Используя в качестве титранта раствор перманганата калия, чаще всего титруют в кислой среде. KMnO4 – сильный окислитель, который в присутствии восстановителей (NH3, органические примеси) изменяет свою концентрацию. Поэтому приготовленный вначале концентрированный раствор KMnO4 выдерживают 7-10 дней в темном месте для того, чтобы прошли все окислительно-восстановительные процессы с примесями восстановителей, содержащимися в воде и попавшими в раствор с пылью. Титрант KMnO4 неустойчив на свету:
|
|
|
4MnO4¯+2H2O = 4MnO2↓+3О2+4OH−
Растворы его хранят в темной склянке. После того, как концентрация раствора KMnO4 становится постоянной, его разбавляют и стандартизируют по свежеперекристаллизованной щавелевой кислоте H2C2O4·2Н2О или по оксалату натрия Na2C2O4:
 5 C2O42– – 2e → 2CO2
5 C2O42– – 2e → 2CO2
 2 MnO4¯+8H+ +5e →Mn2++4H2O
2 MnO4¯+8H+ +5e →Mn2++4H2O
5C2O42– + 2MnO4¯+ 16H+ ↔ 10CO2 + 2Mn2+ + 8H2O
Эта реакция относится к типу автокаталитических. Она катализируется ионами Mn2+. Первые капли перманганата даже в горячем растворе обесцвечиваются очень медленно. В ходе титрования концентрация ионов Mn2+ возрастает, и скорость реакции увеличивается – реакция сама себе поставляет катализатор. Индикатором в этом титровании является сам KMnO4, который интенсивно окрашен и избыточная капля реагента легко обнаруживается по собственной окраске. Титрование раствора до бледно-розового окрашивания, не исчезающего в течение 30 с, – обычный способ фиксирования точки эквивалентности в перманганатометрии. Перманганатометрически определяют восстановители методом прямого титрования, окислители – методом обратного титрования и некоторые вещества, не обладающие окислительно-восстановительными свойствами, – титрованием по замещению.
Определение восстановителей
Пероксид водорода Н2О2
 5 Н2О2 – 2e → O2 + 2H+
5 Н2О2 – 2e → O2 + 2H+
2 MnO4─ +8H++5e → Mn2+ + 4H2O
 5 Н2О2 + 2 MnO4─ + 6H+ → O2 + 2Mn2+ + 8H2O
5 Н2О2 + 2 MnO4─ + 6H+ → O2 + 2Mn2+ + 8H2O
Нитриты
NO2 +H2O – 2е →2H++NO3
Однако самое широкое распространение метод перманганатометрии получил при определении железа:
5Fe2+ + MnO4– + 8H+ = 5Fe3+ + Mn2+ + 4H2O
Если в анализируемом растворе находятся ионы Fe3+, то их необходимо восстановить до железа(II). Восстановление проводят либо с помощью металлов или их амальгам (например, амальгама цинка) или с помощью SnCl2. Восстановление Fe(III) раствором SnCl2 в солянокислой среде происходит по уравнению:
|
|
|
2FeCl2+ + SnCl42– = 2Fe2+ + SnCl4 + 2Cl–
Избыток Sn(II) удаляется с помощью раствора сулемы:
SnCl42–+ 2HgCl2 = SnCl4 + Hg2Cl2 + 2Cl–
Другим распространенным приемом восстановления Fe(III) является использование редуктора Джонса, заполненного амальгамой цинка:
2Fe3++ Zn → 2Fe2+ + Zn2+
Титрование Fe(II) проводят в присутствии защитной смеси, состоящей из раствора MnSО4, H2SO4 и H3PO4. Сульфат марганца предотвращает окисление хлорид-ионов, фосфорная кислота образует бесцветный комплекс с Fe(III), что приводит к более четкому установлению точки эквивалентности, серная кислота обеспечивает необходимую кислотность раствора.
Наряду с Fe2+ можно с предварительным восстановлением титровать V, Mo, W, U, Ti, Nb, Sn, Sb.
Аналогично кривым титрования кислотно-основного метода строят кривые титрования и в окислительно-восстановительном титровании.
Рассчитаем кривую титрования 100,0 мл 0,1 н FeSO4 раствором KMnO4 с концентрацией С(1/5 KMnO4) = 0,1 моль/л в кислой среде при [H+] = 1моль/л в соответствии с уравнением реакции
5Fe2+ + MnO4– + 8H+ = 5Fe3+ + Mn2+ + 4H2O
В кислотно-основном титровании в зависимости от количества прибавленного титранта изменялся pH раствора. В окислительно-восстановительном титровании изменяется величина E – окислительно-восстановительного потенциала.
После добавления первых же капель перманганата калия в растворе образуется две окислительно-восстановительные пары: MnO4–/Mn2+ и Fe3+/Fe2+, потенциал каждой из которых можно вычислить по уравнению Нернста:


При расчете по любому из этих уравнений получится одно и то же значение потенциала. Однако из соображений простоты расчета до точки эквивалентности потенциал до точки эквивалентности целесообразно рассчитывать по второму уравнению, а после точки эквивалентности – по первому. Рассчитаем значение потенциала системы при прибавлении разных объемов раствора титранта.
1. Добавлено 0 мл раствора KMnO4
В растворе не могут присутствовать только ионы Fe2+, всегда есть ионы Fe3+. Берем любое малое соотношение [Fe3+]/[Fe2+], например, 1/10000 или 1/1000.
E = 0,77+0,059lg10–4= 0,53 В
2. Добавлено 50 мл раствора KMnO4
E = 0,77 B
3. Добавлено 90 мл раствора KMnO4
Е=0,77+0,059lg(90/10) = 0,83 B
4. Добавлено 99 мл раствора KMnO4
Е=0,77+0,059lg(99/1) = 0,89 В
5. Добавлено 100 мл раствора KMnO4 – точка эквивалентности. Выведем формулу для расчета потенциала в точке эквивалентности. Для этого сложим два уравнения, предварительно умножив одно из них на пять:
|
|
|
 и
и

Получаем:

В точке эквивалентности с учетом уравнения реакции
5Fe2++MnO4-+8H+ ó5Fe3++Mn2++4H2O
[Fe2+] = 5[MnO4-]
[Fe3+] = 5[Mn2+],
тогда 
С учетом этого, а также того, что [H+] = 1 моль/л, получаем
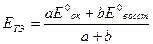 ,
,
где а и b – число принятых или отданных электронов в полуреакциях.
Потенциал в точке эквивалентности Е = (0,77 + 5·1,51) / 6 = 1,39 В.
6. 100,1 мл раствора KMnO4, т.е. избыток титранта 0,1 мл.

 Скачок титрования наблюдается от 0,95 В до 1,47 В (рис. 14.1).
Скачок титрования наблюдается от 0,95 В до 1,47 В (рис. 14.1).
Рис. 14.1. Кривая титрования 100 мл 0,1 М FeSO4 0,1 н раствором KMnO4 (f = 1/5)
В методе перманганатометрии тирование можно проводить без индикатора, т.к. первая избыточная капля раствора KMnO4 окрасит титруемый раствор в слабо розовый цвет. Но в других методах окислительно-восстановительного титрования используют специальные окислительно-восстановительные индикаторы.
|
|
|


