 |
Практическое применение комплексонометрии
|
|
|
|
Этот метод применяется для определения многих катионов. Прямым комплексонометрическим титрованием с различными индикаторами определяют Ca2+, Mg2+, Zn2+, Cd2+, Pb2+, Co2+, Ni2+, Cu2+, Fe3+ и другие элементы. Многие элементы не могут быть определены прямым титрованием. Причиной является или отсутствие подходящего индикатора, или недостаточная скорость реакции комплексообразования при обычной температуре, или «блокирование» индикатора в результате слишком высокой прочности комплекса катион-индикатор по сравнению с комплексом катион-комплексон. Методом обратного титрования определяют Hg2+, Al3+, Cr3+ и др.
Определение жесткости воды.
Жесткость характеризуют молярной концентрацией эквивалентов кальция и магния (f = ½) и выражают в моль/л. Содержание Ca2+ и Mg2+ определяют прямым титрованием пробы воды в аммонийном буферном растворе в присутствии эриохрома черного Т как индикатора и рассчитывают по формуле:
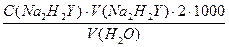 ,
,
где V(H2O) – объем воды, взятый для титрования, мл.
Тяжелые металлы предварительно осаждают в виде сульфидов. Можно определить раздельное содержание Ca2+ и Mg2+. Жесткость воды, обусловленную содержанием солей кальция, можно определить титрованием пробы с мурексидом в щелочной среде и далее по разности рассчитать жесткость, связанную с присутствием солей магния. Большие содержания NaCl не мешают титрованию. Поэтому можно титровать и морскую воду.
На результат титрования Ca2+ и Mg2+ не влияет содержания сахара. Поэтому метод используют для определения Ca2+ и Mg2+ в различных соках на сахароваренных заводах и предприятиях пищевой промышленности. Комплексонометрически определяют Ca2+ и Mg2+ в сульфитных и других щелоках на предприятиях бумажной промышленности.
|
|
|
Комплексонометрический метод определения жесткости воды включен в международные стандарты.
Определение сульфата, фосфата и других анионов.
Определение многих анионов основано на осаждении их малорастворимых соединений титрованным раствором какого-либо катиона, избыток которого затем оттитровывается ЭДТА. Сульфат по этой методике определяют осаждением BaSO4 хлоридом бария и последующим комплексонометрическим титрованием избытка ионов Ba2+ по специальной методике. Фосфат осаждают в виде MgNH4PO4, и оставшееся в растворе количество магния определяют комплексонометрически.
Аргентометрия
Из методов осаждения наибольшее практическое значение имеют методы, основанные на осаждении нитратом серебра (аргентометрия) и нитратом ртути(I) (меркурометрия).
Аргентометрические методы применяют для определения концентрации главным образом галогенидов:
X– + Ag+ ó AgX↓,
где X = Cl–, Br–, I–, SCN–.
Титрант AgNO3 хранят в склянках из темного стекла, т.к. на свету соли серебра неустойчивы. Стандартизуют раствор AgNO3 по NaCl.
Кривые титрования в аргентометрии обычно строят в координатах pAg – V или рСl – V, где pAg и pCl– взятые с обратным знаком логарифмы концентраций ионов Ag+ или Cl–, V – объем титранта.
рис. 14.6. 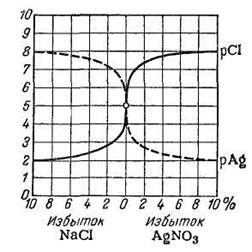 Сплошная кривая показывает изменение pCl, а пунктирная – изменение pAg при титровании.
Сплошная кривая показывает изменение pCl, а пунктирная – изменение pAg при титровании.
Рис. 14.6. Кривая титрования 0,1 М раствора NaCl 0,1 M раствором
AgNO3 (или наоборот)
Кривая аргентометрического титрования сохраняет традиционный вид. Скачок титрования – изменение pAg от 5,74 до 4,00.
На рис. 14.7 приведены кривые аргентометрического титрования NaCl, NaBr и NaI.
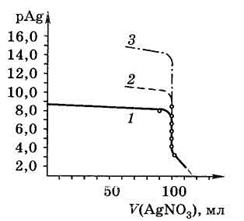 Рис. 14.7. Кривые аргентометрического титрования: 1 – NaCl; 2 – NaBr; 3 – NaI
Рис. 14.7. Кривые аргентометрического титрования: 1 – NaCl; 2 – NaBr; 3 – NaI
Видно, что скачок на кривой титрования зависит от ПР: чем меньше ПР соли серебра, образующейся при титровании, тем больше величина скачка.
|
|
|


