 |
Комплексонометрическое титрирование
|
|
|
|
Этот метод еще называют хелатометрия. Он основан на образовании внутрикомплексных соединений (хелатов) металлов со специальными органическими комплексообразующими реактивами – полиаминополикарбоновыми кислотами (комплексонами). Хотя число различных комплексонов в настоящее время составляет не одну сотню, под термином «комплексонометрическое титрование» обычно подразумевают титрование солями этилендиаминтетрауксусной кислоты (ЭДТА), чаще всего раствором ее двухзамещенной натриевой соли Na2H2Y·2H2O (комплексон III), широко известный под торговым названием трилон Б.
 Этилендиаминтетрауксусная кислота является четырехосновной кислотой. Распределительная диаграмма для ЭДТА (H4Y) представлена на рис. 14.3 (х – мольная доля отдельных форм):
Этилендиаминтетрауксусная кислота является четырехосновной кислотой. Распределительная диаграмма для ЭДТА (H4Y) представлена на рис. 14.3 (х – мольная доля отдельных форм):
Рис. 14.3. Диаграмма равновесий в растворе ЭДТА
На диаграмме распределения выделяют 3 буферные области:
H2Y2– pH = 2-4
HY3- pH = 6-9
Y4– pH > 9
Комплексы в сильнокислой среде могут присоединять протоны MHY(n-3)+, а в щелочном растворе – гидроксогруппы M(OH)(n-1-4)+. Так, ионы Al(III), Fe(III), Bi(III), Ga(III), In(III), Th(IV) присоединяют гидроксогруппу уже в слабокислой и нейтральной средах. Есть смешанолигандные комплексы MYL или MHYL (для больших ионов металлов – лантаноидов).
Структурная формула динатриевой соли ЭДТА (комплексона III):

Реакции взаимодействия различных катионов с ЭДТА в растворе протекают по уравнениям:
Ca2++H2Y2- ó CaY2-+ 2Н+
Bi3++H2Y2- ó BiY– + 2H+
Zr4++H2Y2- ó ZrY + 2Н+
Следствия:
1) Образование в результате реакции титрования только соединения состава 1:1 (МY) и отсутствие в условиях титрования продуктов ступенчатого комплексообразования. Молярная масса эквивалентна титранта (трилона Б) и определяемого катиона равны молярным массам.
|
|
|
2) Из уравнений видно, что степень протекания реакций зависит от рH раствора. Видно, что взаимодействие должно протекать в щелочной среде. Однако некоторые катионы могут реагировать с комплексоном III и в кислой среде. В этом случае равновесие может сдвинуть вправо образование очень прочного комплекса. Влияние кислотности раствора особенно заметно при титровании катионов, образующих малоустойчивые комплексы (Mg2+, Ca2+ и др.): их можно оттитровать лишь в щелочной среде. Многие катионы титруются в аммиачном буферном растворе (Zn2+, Cd2+ и др.). Катионы, образующие очень устойчивые комплексы, как например, Fe3+, могут быть оттитрованы в довольно кислом растворе.
3) В ходе титрования выделяется ионы H+, изменяется значение pH титруемого раствора. Поэтому титрование комплексоном Ш обычно проводят в подходящем буферном растворе.
В методе комплексонометрии кривая титрования представляет собой зависимость равновесной концентрации иона металла от состава раствора. Обычно используют величину – lg[Mn+] = pM в зависимости от объема титранта – комплексона Ш.
 Построим кривую титрования при рН=10 (рис. 14.4.), а также нанесем на рис. 14.4 кривые титрования иона кальция в буферных растворах с различными значениями рН. Видно, что с уменьшением рН величина скачка титрования уменьшается.
Построим кривую титрования при рН=10 (рис. 14.4.), а также нанесем на рис. 14.4 кривые титрования иона кальция в буферных растворах с различными значениями рН. Видно, что с уменьшением рН величина скачка титрования уменьшается.
Рис. 14.4. Влияние рН на титрование 50 мл 0,01 М раствора Ca2+ 0,01 М раствором Na2H2ЭДТА
На рис. 14.5 показаны кривые комплексонометрического титрования катионов, образующих с ЭДТА комплексы различной устойчивости. Видно, что чем прочнее комплекс, тем больше скачок на кривой титрования. Заметим, что катионы многих тяжелых двухвалентных металлов можно оттитровать в умеренно кислых растворах, а ионы железа(III) – в сильно кислой среде.
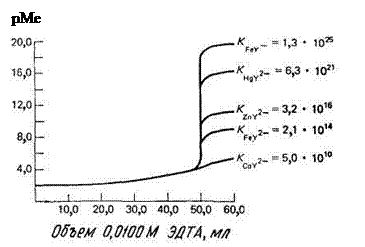 |
Рис. 14.5. Кривые титрования 50 мл 0,01 М раствора катионов при рН 6,0
Индикаторы
В комплексонометрии используют разные индикаторы. Но чаще других – металлохромные индикаторы. Они в свободном виде обладают одним цветом, а в комплексе с металлом – другим. Первым индикатором такого типа был мурексид. Его открыли случайно в лаборатории, занимающейся синтезом комплексонов. Было замечено, что когда после работы с урамилдиуксусной кислотой колбу мыли водопроводной водой, происходило резкое изменение окраски. Оказалось, что изменение окраски вызывается реакцией ионов Са2+, содержащихся в водопроводной воде, с мурексидом, который образовывался при окислении урамилдиуксусной кислоты кислородом воздуха.
|
|
|
Требования к металлохромным индикаторам:
1) Образующийся комплекс металла с индикатором должен быть слабее, чем комплекс металла с ЭДТА (примерно в 10-100раз).
2) Интервал перехода индикатора должен находиться в пределах скачка титрования.
Сейчас получено более 150 индикаторов. Наиболее известный из них – эриохром черный Т (общая формула H3Ind):
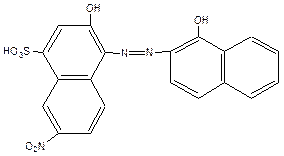
Протон в сульфогруппе в растворе диссоциирует практически нацело, поэтому форма нахождения индикатора в растворе H2Ind–. Отщепление H+-ионов (диссоциация) от гидроксильных групп приводит к изменению цвета индикатора:
рН=6,3 pH=11,5
H2Ind– ó HInd2– ó Ind3–
винно- голубой оранжевый
красный
Если титровать в аммиачном буферном растворе, то преобладает голубая форма индикатора:
Me2+ + HInd2– + NH3 ó MeInd– + NH4+
голубой красный
Образующийся комплекс имеет строение:

Далее титруем раствором комплексона Ш, комплекс металла с индикатором менее прочный, он разрушается:
MeInd–+ HY3– + NH3 ó MeY2–+HInd2-+NH4+
красный голубой
Таким образом, в точке эквивалентности мы видим цвет свободного индикатора в аммиачном буфере.
С эриохромом черным Т окрашенные соединения образуют многие (>20) катионы. Однако методом титрования могут быть определены лишь некоторые их них – Mg2+, Ca2+, Zn2+, Pb2+.
В кислой среде с эриохромом титровать нельзя. В кислой среде для титрования используют ксиленоловый оранжевый (I) или пирокатехиновый фиолетовый (II).
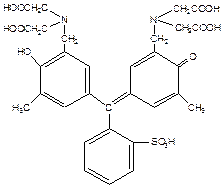
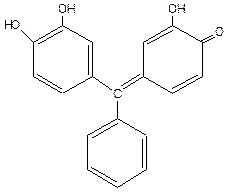
I II
Используют также специфические индикаторы. Например, Fe3+ титруют с SCN–– ионами либо c cульфосалициловой кислотой, Bi3+ – c тиомочевиной.
|
|
|


