 |
Равновесие в растворах слабых электролитов
|
|
|
|
Электролитическая диссоциация слабых электролитов - процесс обратимый в связи с тем, что в их растворах одновременно имеются и недиссоциированные молекулы, и ионы. Следовательно, в растворах слабых электролитов имеет место химическое равновесие, выражающееся в равенстве скоростей диссоциации 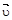 и ассоциации
и ассоциации  :
:
(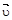 =
=  )
)
СН3СООН ⇄ СН3СОО– + Н+,
 [СН3СООН] =
[СН3СООН] =  [СН3СОО–][Н+]; (2.1)
[СН3СОО–][Н+]; (2.1)
NН3 · Н2О ⇄ NН4+ + ОН–,
 [NН3 · Н2О] =
[NН3 · Н2О] =  [NН4+][ОН–]. (2.2)
[NН4+][ОН–]. (2.2)
Скорости диссоциации и ассоциации в водных растворах очень велики, поэтому равновесие в растворах слабых электролитов устанавливается очень быстро (τ < 0,001 с).
На основании закона действующих масс, электролитическое равновесие в растворе слабого электролита можно количественно выразить величиной константы диссоциации. В случае слабой кислоты эта величина обозначается Ка(асid – кислота), в случае слабых оснований – Кb(bаsе – основание):
СН3СООН ⇄ СН3СОО– + Н+,
Ка = 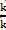 =
=  ; (2.3)
; (2.3)
NН3 · Н2О ⇄ NН4+ + ОН–,
Кb = 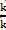 =
=  . (2.4)
. (2.4)
Величина константы электролитической диссоциации как константы истинного равновесия не зависит от концентрации слабого электролита в растворе, но зависит от следующих факторов:
- природы вещества (табл. 1);
- природы растворителя (с увеличением диэлектрической проницаемости среды ε Кg возрастает);
- температуры (при повышении температуры Kg увеличивается).
Значения констант диссоциации слабых электролитов много меньше единицы (К << 1, табл. 1), и поэтому вместо констант диссоциа-ции используют показатели этих величин рКа и рКb: рКа = –lgКа и рКb = –lgКb. Чем меньше значение рКа (то есть, чем больше значение константы диссоциации), тем в большей степени это вещество распадается на ионы и тем сильнее электролит.
|
|
|
Электролитическая диссоциация многоосновных кислот (Н3РО4, Н2СО3) и многокислотных оснований [Сa(ОН)2, Fe(OH)3] протекает ступенчато. При этом первая ступень протекает в значительно большей степени, чем последующие. Например;
| I ступень: | Н3РО4 ⇄Н+ + Н2РО4– |
 = 7,5 · 10–3 = 7,5 · 10–3
|
р  = 2,12 = 2,12
|
| II ступень: | Н2РО4– ⇄Н+ + НРО42– |
 = 6,3 · 10–8 = 6,3 · 10–8
|
р  = 7,20 = 7,20
|
| III ступень: | НРО42– ⇄Н+ + РО43– |
 = 1,3 · 10–12 = 1,3 · 10–12
|
р  = 11,89. = 11,89.
|
Ступенчатая электролитеская диссоциация характеризуется значениями констант диссоциации, уменьшающимися в следующей последовательности:
К1 > К2 > К3 >... > Кn.
В связи со ступенчатой диссоциацией многоосновные кислоты способны образовывать кислые соли (NаН2РО4 – дигидрофосфат натрия, Nа2НРО4 – гидрофосфат натрия).
Таблица 1
Константы диссоциации некоторых слабых электролитов
в водных растворах при 25 0С
| Кислота | Ка | рКа = – lg Ка | ||
| Азотистая | HNO2 | 4,0 ∙ 10-4 | 3,40 | |
| Метакремниевая | Н2SiO3 | К1 | 2,2 ∙ 10-10 | 9,66 |
| K2 | 1,6 ∙ 10-12 | 11,80 | ||
| Серная | Н2SO4* | K2 | 1,2 ∙ 10-2 | 1,92 |
| Сернистая | Н2SO3 | К1 | 1,6 ∙ 10-2 | 1,80 |
| K2 | 6,3 ∙ 10-8 | 7,21 | ||
| Сероводородная | Н2S | К1 | 6,0 ∙ 10-8 | 7,22 |
| K2 | 1,0 ∙ 10-14 | 14,00 | ||
| Угольная | Н2СО3 | К1 | 4,5 ∙ 10-7 | 6,35 |
| K2 | 4,7 ∙ 10-11 | 10,33 | ||
| Уксусная | СН3СООН | 1,8 ∙ 10-5 | 4,75 | |
| Ортофосфорная | Н3РО4 | К1 | 7,5 ∙ 10-3 | 2,12 |
| K2 | 6,3 ∙ 10-8 | 7,20 | ||
| К3 | 1,3 ∙ 10-12 | 11,89 | ||
| Фтороводородная | НF | 6,6 ∙ 10-4 | 3,18 | |
| Хлорноватистая | НОСl | 5,0 ∙ 10-8 | 7,30 | |
| Циановодородная | НСN | 7,9 ∙ 10-10 | 9,10 | |
| Основание | Кb | рКb = – lg Кb | ||
| Гидрат аммиака | NH3 · Н2О | 1,8 ∙ 10-5 4 ∙ 10-13 1,38 ∙ 10-9 1,3 ∙ 10-4 1,82 ∙ 10-11 4 ∙ 10-5 4,5 · 10–4 4,3 · 10–10 | 4,75 | |
| Гидроксид алюминия | Аl(ОН)3 | 12,39 | ||
| К3 | 8,86 | |||
| Гидроксид железа(II) | Fe(OH)2* | K2 | 3,88 | |
| Гидроксид железа(III) | Fe(OH)3* | K2 | 10,73 | |
| Гидроксид цинка | Zn(OH)2* | K2 | 4,39 | |
| Метиламина гидрат | СН3NН2 · Н2О | 3,34 | ||
| Анилин | С6Н5NН2 | 9,37 | ||
| * Сильный электролит, поэтому не указаны первые константы диссоциации. |
|
|
|
Ступенчатой диссоциацией оснований многозарядных металлов объясняется их способность образовывать основные соли (FеОНСl – гидроксохлорид железа, Аl(ОН)2NО3 – дигидроксонитрат алюминия).
|
|
|


