 |
Произведение растворимости и
|
|
|
|
ОБРАЗОВАНИЕ ОСАДКОВ
Произведение растворимости
Поместим в химический стакан какую-либо малорастворимую соль, например хлорид серебра (AgCl), и добавим к образовавшемуся осадку дистиллированной воды. При этом ионы Ag+ и С1–, испытывая притяжение со стороны окружающих диполей воды, постепенно отрываются от кристаллов и переходят в раствор. Сталкиваясь в растворе, ионы Ag+ и Сl– образуют молекулы AgCl↓ и осаждаются на поверхности кристаллов. Таким образом, в системе происходят два взаимно противоположных процесса, что приводит к динамическому равновесию, когда в единицу времени в раствор переходит столько же ионов Ag+ и Сl–, сколько их осаждается. Накопление ионов Ag+ и Сl– в растворе прекращается, получается насыщенный раствор. Следовательно, в системе находится осадок малорастворимой соли в соприкосновении с её насыщенным раствором. При этом происходят два взаимно противоположных процесса:
- переход ионов из осадка в раствор. Скорость этого процесса можно считать постоянной при неизменной температуре: υ1 = k1;
- осаждение ионов из раствора. Скорость этого процесса υ2 зависит от концентрации или активности ионов Ag+ и Сl–.
По закону действующих масс:
υ2 = k2 [Ag+][Cl–] или υ2 =  . (8.1)
. (8.1)
Так как данная система находится в состоянии химического равновесия, то
υ1 = υ2 или υ1 = k2 [Ag+][Cl–].
Для нерастворимого хлорида серебра АgСl, образующего твёрдую фазу, процесс его электролитической диссоциации характеризуется константой равновесия:
[Ag+][Cl–] =  = Кр = const (при Т = const).
= Кр = const (при Т = const).
Константа равновесия диссоциации малорастворимого электролита в его насыщенном растворе называется произведением растворимости (ПР).
|
|
|
В приведенном примере ПРАgСl = [Ag+][Cl–]. В тех случаях, когда электролит содержит два или несколько одинаковых ионов, концентрация этих ионов при вычислении произведения растворимости должна быть возведена в соответствующую степень.
Например, для сульфида серебра ПРАgСl = [Ag+]2[S2–], a иодида свинца ПРАgСl = [Рb2+][I–]2.
В общем случае выражение произведения растворимости для малорастворимого электролита типа АmВn описывается уравнением:
 = [А]m[В]n. (8.2)
= [А]m[В]n. (8.2)
Более строго произведение растворимости выражается через произведение активностей ионов:
ПР = 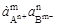 .
.
Однако ввиду того, что определение активностей отдельных ионов во многих случаях представляет неразрешимую задачу, при проведении расчётов их активности с достаточной степенью погрешности могут быть заменены концентрациями.
Величины произведений растворимости у разных электролитов различны. Например, для карбоната кальция  = 4,8 · 10–9, a для хлорида серебра – ПРАgСl = 1,56 · 10–10.
= 4,8 · 10–9, a для хлорида серебра – ПРАgСl = 1,56 · 10–10.
ПР легко вычислить, зная растворимость соединения при данной температуре.
Пример. Растворимость карбоната кальция СаСО3 равна 0,0069 г/л. Найти  .
.
Решение. Выразим растворимость (S)карбоната кальция в молях:
 = 40 + 12 + 3 · 16 = 100 г/моль;
= 40 + 12 + 3 · 16 = 100 г/моль;
 =
=  = 6,9 · 10–5 моль/л.
= 6,9 · 10–5 моль/л.
Так как каждая формульная единица СаСО3 дает при растворении по одному иону Са2+ и СО32–, то:
[Са2+] = [СО32–] = 6,9 · 10–5 моль/л
Следовательно,  = [Са2+][СО32–] = (6,9 · 10–5) 2 = 4,8 · 10–9.
= [Са2+][СО32–] = (6,9 · 10–5) 2 = 4,8 · 10–9.
Зная величину ПР, можно вычислить растворимость электролита в моль/л или г/л.
Образование осадков
Если [Ag+][Cl–] < ПPAgСl, то раствор ненасыщенный; если [Ag+][Cl–] = ПРАgСl, то раствор насыщенный; в случае когда [Ag+][Cl–] > ПPAgСl, раствор становится пересыщенным.
Осадок образуется в том случае, когда произведение концентраций ионов малорастворимого электролита превысит величину его произведения растворимости при данной температуре. Когда ионное произведение станет равным величине ПР, выпадение осадка прекращается. Зная объем и концентрацию смешиваемых растворов, можно рассчитать, будет ли выпадать осадок образующейся соли.
|
|
|
Пример. Выпадет ли осадок хлорида свинца при смешении равных объёмов растворов нитрата свинца Pb(NO3)2 и хлорида натрия NaCl с одинаковыми концентрациями 0,2 моль/л, если  = 2,12 · 10–4.
= 2,12 · 10–4.
Решение. При смешении объем растворов возрастёт вдвое и концентрация каждого из веществ уменьшится вдвое и станет равным 0,1 моль/л. Такими же будут концентрации ионов [Рb2+] и [Сl–]. Следовательно, [Рb2+][Сl–]2 = 0,1 · 0,12 = 10–3. Полученное значение превышает величину  . Поэтому часть РbС12 выпадет в осадок.
. Поэтому часть РbС12 выпадет в осадок.
Влияние концентрации растворов. Малорастворимый электролит с достаточно большой величиной ПР невозможно осадить из разбавленных растворов. Например, осадок хлорида свинца РbС12 не будет выпадать при смешении равных объемов растворов нитрата свинца Pb(NO3)2 и хлорида натрия NaCl с концентрациями 0,1 моль/л. При смешивании равных объёмов концентрации каждого из веществ составит 0,1/2 = 0,05 моль/л.
Ионное произведение [Рb2+][Сl–]2 = 0,05 · 0,052 = 1,25 · 10–4. Полученное значение меньше величины  , следовательно, выпадения осадка не произойдет.
, следовательно, выпадения осадка не произойдет.
Влияние количества осадителя. Для возможно более полного осаждения употребляют избыток осадителя. Например, осаждается карбонат бария ВаСО3:
ВаС12 + Na2CO3 = ВаСО3↓ + 2NaCl.
После прибавления в раствор хлорида бария эквивалентного количества карбоната натрия в растворе остаются ионы Ва2+, концентрация которых обусловлена величиной 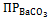 .
.
Повышение концентрации ионов СО32–, вызванное прибавлением избытка осадителя Na2CO3, повлечёт за собой соответственное уменьшение концентрации ионов Ва2+ в растворе, то есть увеличит полноту их осаждения.
Влияние общего иона. Растворимость малорастворимых электролитов понижается в присутствии сильных электролитов, имеющих общие ионы. Если к ненасыщенному раствору сульфата бария BaSO4 понемногу прибавлять раствор сульфата натрия Na2SO4, то ионное произведение, которое было сначала меньше  (табл. 7), постепенно достигнет величины ПР и превысит его. Начнется выпадение осадка BaSO4. Этим приемом широко пользуются на практике для увеличения полноты осаждения веществ из растворов.
(табл. 7), постепенно достигнет величины ПР и превысит его. Начнется выпадение осадка BaSO4. Этим приемом широко пользуются на практике для увеличения полноты осаждения веществ из растворов.
|
|
|
Влияние температуры. ПР является постоянной величиной при постоянной температуре. С увеличением температуры величина ПР возрастает, поэтому осаждение лучше проводить из охлажденных растворов.
Растворение осадков. Правило произведения растворимости важно также и для решения обратной задачи – перевода малорастворимых веществ в раствор. Предположим, что надо растворить осадок карбоната бария (ВаСО3). Раствор, соприкасающийся с этим осадком, насыщен относительно ВаСО3.
Это означает, что [Ва2+][СО32–] = 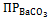 .
.
Если добавить в раствор кислоту, то ионы Н+ свяжут имеющиеся в растворе ионы СО32– в молекулы слабой угольной кислоты, которая затем разлагается на воду и диоксид углерода:
2Н+ + СО32– = Н2СО3 = Н2О + CO2↑.
Вследствие этого резко снизится концентрация ионов СО32– в растворе и ионное произведение [Ва2+][СО32–] станет меньше величины 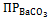 . Раствор окажется ненасыщенным относительно ВаСО3 и часть его из осадка перейдёт в раствор. При добавлении достаточного количества кислоты можно весь осадок перевести в раствор. Следовательно, растворение осадка начинается тогда, когда по какой-либо причине значение ионного произведения малорастворимого электролита становится меньше величины ПР. Для того чтобы растворить осадок, в раствор вводят такой электролит, ионы которого могут образовывать слабо диссоциирующее соединение с одним из ионов малорастворимого электролита. Этим объясняется растворение малорастворимых гидроксидов металлов в кислотах. Например:
. Раствор окажется ненасыщенным относительно ВаСО3 и часть его из осадка перейдёт в раствор. При добавлении достаточного количества кислоты можно весь осадок перевести в раствор. Следовательно, растворение осадка начинается тогда, когда по какой-либо причине значение ионного произведения малорастворимого электролита становится меньше величины ПР. Для того чтобы растворить осадок, в раствор вводят такой электролит, ионы которого могут образовывать слабо диссоциирующее соединение с одним из ионов малорастворимого электролита. Этим объясняется растворение малорастворимых гидроксидов металлов в кислотах. Например:
Fe(OH)3↓ + 3НСl = FeCl3 + 3Н2О.
Ионы ОН– связываются в незначительно диссоциирующиеся молекулы Н2О.
Величины ПР и растворимости различных соединений в воде при определённой температуре, необходимые для проведения соответствующих расчётов, приводятся в специальных таблицах. В качестве примера некоторые из этих данных представлены в табл. 7.
Таблица 7
Произведение растворимости (ПР) и растворимость при 25 0С
|
|
|


