 |
Методы определения рН растворов
|
|
|
|
Для определения величины рН водных растворов используют индикаторный или ионометрический метод.
Индикаторный метод применяется в том случае,когда необходимо быстро приблизительно оценить кислотность раствора. Индикаторным методом невозможно определить рН мутных и окрашенных растворов.
Ионометрический метод позволяет определить кислотность растворов с большей точностью (0,01 единицы рН), причём и мутных, и окрашенных и любых других водных растворов.
Индикаторный метод основан на применении кислотно-основных индикаторов – веществ, изменяющих свою окраску в зависимости от рН среды. Кислотно-основные индикаторы представляют собой слабые органические кислоты (или основания), у которых цвет нейтральной (неионизированной) и заряженной (ионизированной) форм различен, а диссоциация протекает по уравнению:
| НInd | 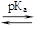
| Ind– + Н+ |
| нейтральная форма, окраска 1 | Смесь обеих форм, переходная окраска | заряженная форма, окраска 2 |
| (при рН < рКа – 1) | (ΔрН = рКа ± 1) | (при рН > рКа + 1) |
Поведение индикатора как слабого электролита подчиняется закономерностям влияния общего иона Н+. Чем больше концентрация водородных ионов, тем больше смещено равновесие в направлении образования молекул Hind, и раствор имеет окраску, соответствующую нейтральной форме индикатора. С уменьшением концентрации ионов Н+ увеличивается концентрация ионизованной формы, и раствор приобретает окраску ионизированной формы Ind–.
Интервал между двумя значениями рН (pH1 – рН2 = ΔрН), в пределах которого в сравнимых количествах (от 1: 10 до 10: 1) существуют обе формы индикатора и происходит различимое глазом изменение цвета раствора, называется интервалом перехода окраски индикатора: ΔрН = рКа ± 1.
|
|
|
Положение интервала перехода окраски индикатора на шкале значений рН зависит от величины его рКа, то есть от природы индикатора. В интервале от рН1 до рН2 наблюдается постепенный переход окраски 1 индикатора в окраску 2 и наоборот. Количественно оценить величину рН при помощи индикаторов можно только в области перехода их окраски (табл. 5). В других случаях возможна только качественная оценка кислотности раствора рН < рКа – 1 или рН > рКа + 1.
Для приблизительной оценки кислотности растворов (с погрешностью до единицы рН) применяют универсальный индикатор.
Универсальный индикатор представляет смесь кислотно-основных индикаторов, позволяющая определить значение рН от 1 до 10.
Таблица 5
Кислотно-основные индикаторы
| Индикатор | рКа | Интервал перехода окраски | ||
| окраска 1 | pH1 – pH2 | окраска 2 | ||
| Метиловый оранжевый | 3,7 | Красная | 3,1 – 4,4 | Жёлтая |
| Метиловый красный | 5,1 | Красная | 4,2 – 6,3 | Жёлтая |
| Лакмус | 7,0 | Красная | 6,0 – 8,0 | Синяя |
| Фенолфталеин | 9,2 | Бесцветная | 8,2 – 10,0 | Малиновая |
Универсальный индикатор обычно нанесён на бумагу, которую смачивают исследуемым раствором и сравнивают полученную окраску с прилагаемой колориметрической шкалой рН. Этот метод широко используют в практике для быстрого определения значения рН растворов.
Ионометрический метод определения рН основан на измерении милливольтметром-ионометром потенциала стеклянного электрода, чувствительного к изменению концентрации ионов Н+ в растворе. Ионометрический метод, позволяющий определить водородный показатель с погрешностью до 0,01 рН, широко применяется в практике для определения величины рН различных сред.
БУФЕРНЫЕ РАСТВОРЫ
Растворы, рН которых относительно мало изменяется при добавлении небольших количеств кислоты или основания, называются буферными.
|
|
|
Буферные растворы содержат либо слабую кислоту и её соль, содержащую катион сильного основания, либо слабое основание и его соль, содержащие анион сильной кислоты (табл. 6).
Таблица 6
Буферные системы
| Состав буферной смеси (при молярном соотношении 1: 1) | Название смеси | рН |
| Смесь муравьиной кислоты НСООН и формиата натрия НСООNа | Формиатная | 3,7 |
| Смесь уксусной кислоты СН3СООН и ацетата натрия СН3СООNа | Ацетатная | 4,7 |
| Смесь дигидрофосфата натрия NаН2РО4 и гидрофосфата натрия Nа2НРО4 | Фосфатная | 6,6 |
| Смесь раствора аммиака NН3*Н2О и хлорида аммония NН4Сl | Аммонийная | 9,3 |
Действие буферных растворов можно объяснить на основе закона действующих масс.
Рассмотрим в качестве примера ацетатный буферный раствор:
CH3COOH + CH3COONa.
Уксусная кислота – слабый электролит, её диссоциация в водном растворе описывается уравнением:
СН3СООН ⇄ СН3СОО– + Н+
 =
= 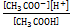 . (6.1)
. (6.1)
Ацетат натрия – сильный электролит, и в водном растворе диссоциирует практически полностью:
СН3СООNа → СН3СОО– + Nа+
Под влиянием общего ацетат-иона СН3СОО– равновесие диссоциации слабого электролита – уксусной кислоты – смещается влево, то есть диссоциация подавляется.
Вследствие незначительной диссоциации, концентрация СН3СООН в буферном растворе практически не отличается от исходной концентрации кислоты (скисл.), а равновесная концентрация ацетат-иона СН3СОО– практически не отличается от концентрации соли (ссоли).
Преобразуем уравнение (6.1):
Ка = 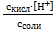 или [Н+] = Ка·
или [Н+] = Ка· 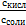 . (6.2)
. (6.2)
Чтобы от концентрации ионов [Н+] перейти к рН нужно прологарифмировать уравнение (6.2) и изменить знаки на обратные:
–lg[Н+] = –lgКа – lg с кисл. + lg с соли (6.3)
Так как pH = lg[H+], а pK = -lgKa, то
рН = рКа – lg 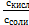 (6.4)
(6.4)
При добавлении к ацетатному буферу небольшого количества сильной кислоты существенного изменения [Н+] не происходит, так как ионы Н+ связывают СН3СОО– в СН3СООН.
Н+ + СН3СОО– ⇄ СН3СООН
При добавлении к ацетатному буферу небольшого количества растворимого в виде основания (щёлочи), образующиеся при её диссоциации ионы ОН– взаимодействуют с ионами Н+ уксусной кислоты.
Н+ + ОН– ⇄ Н2О.
Вместо израсходованных СН3СООН даёт новые ионы Н+, при этом величина рН изменится незначительно.
|
|
|
Не происходит заметного изменения величины рН и при разбавлении ацетатного буферного раствора водой, так как уменьшение при этом концентрации ионов Н+ компенсируется увеличением степени диссоциации (α) уксусной кислоты.
Количество вещества эквивалента сильных кислоты или основания (щёлочи) (моль), необходимое для изменения величины рН на одну единицу 1 л буферного раствора, называется буферной ёмкостью.
Буферное действие прекращается, когда один из компонентов раствора израсходован примерно на 90 %.
Для аммиачного буфера:
[ОН–] = Кb · 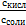 ; (6.5)
; (6.5)
рОН = рКb – lg 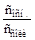 ; (6.6)
; (6.6)
|
|
|


