 |
Особенности растворов сильных электролитов. Ионная сила раствора
|
|
|
|
В водных растворах сильные электролиты (например НСl, NaCl, КОН) полностью диссоциированы, причём гидратированные ионы, образующиеся при этом, обычно не ассоциируются в молекулы (исключение составляет соляная кислота – водный раствор летучего хлороводорода). Поэтому в уравнениях электролитической диссоциации сильных электролитов знак обратимости (⇄) следует заменить знаком односторонней направленности процесса (→):
НСl → Н+ + Сl– ; NаСl → Nа+ + Сl–
Процесс диссоциации сильного электролита, в отличие от диссоциации слабого электролита, нельзя охарактеризовать константой диссоциации, так как этот процесс практически необратим, что приводит к зависимости значения константы диссоциации от концентрации раствора. Вследствие полной диссоциации число ионов в растворе сильных электролитов всегда значительно больше, чем в растворах слабых электролитов той же концентрации.
В концентрированных растворах сильных электролитов ионы расположены близко друг к другу и поэтому сильно взаимодействуют между собой. Это приводит к тому, что ионы в растворах не вполне свободны, и их движение затруднено. Снижение подвижности ионов уменьшает степень их участия в процессах, протекающих в растворе, создавая эффект уменьшения их концентрации. Количественно влияние межионного взаимодействия на поведение иона Xi в растворе сильного электролита характеризуется его активностью а (Хi) и коэффициентом активности γ(Хi).
Активность иона а(Хi)– эффективная концентрация иона Xi, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов.
Коэффициент активности иона γ(Xi) показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита.
|
|
|
Активность иона связана с его молярной концентрацией уравнением:
а (Хi) = γ(Хi) · с (Хi). (3.1)
В бесконечно разбавленных растворах (с < 10–4 моль/л), где концентрации ионов малы и межионное взаимодействие практически отсутствует, γ(Хi) ≈ 1 и активности ионов очень близки их молярным концентрациям:
а (Хi) ≈ с (Хi) (3.2)
Значение коэффициента активности иона зависит от:
– концентрации этого иона;
– температуры;
– концентрации других ионов.
| ДЖИЛЬБЕРТ НЬЮТОН ЛЬЮИС(1875 – 1946) – американский учёный. Родился в городке Уэймут близ Бостона. В 1896 г. окончил Гарвардский университет, в 1899 г. получил степень доктора философии. В 1900 г. отправился в Германию, где работал в основных в то время центрах физической химии – лабораториях В.Оствальда в Лейпциге и В.Нернста в Гёттингене. В 1901 г. вернулся в США, до 1903 г. и в 1906 –1907 гг. работал в Гарвардском университете, в 1904 – 1905 гг. был управляющим Палаты мер и весов в Маниле (Филиппины). В 1907 г. получил место ассистента в Массачусетском технологическом университете в Кембридже, затем – профессора этого университета. В 1912 г. получил место профессора Калифорнийского университета в Беркли, в котором стал деканом химического колледжа при университете. Во время Первой мировой войны занимался разработкой способов защиты от отравляющих веществ. Впервые ввёл по- | 
|
| нятие активности. Однако более известен как создатель электронной теории валентности и первой модели ковалентной связи, а также автор теории кислот и оснований. Достиг значительных результатов в исследовании флуоресценции и фотохимических процессов. Впервые получил тяжёлую воду D2О (1933 г., совместно с Р. Макдональдом), выделил нуклид водорода - дейтерий. Циклы его работ посвящены теории кислот и оснований, комплексообразованию, растворимости, цветности органических соединений. В 1923 г. издал книгу "Валентность и строение атомов и молекул". В последующие годы активно пропагандировал идеи квантовой теории, предвещая ей большое будущее. Слыл новатором и большим оригиналом, подчас шокируя коллег неординарностью своих научных убеждений. Так, Льюис утверждал, что свет распространяется не по всем направлениям от источника, а исключительно в направлении наблюдателя. |
|
|
|
1. При переходе от бесконечно разбавленных растворов, где γ(Хi) ≈ 1, к более концентрированным γ(Хi) с начала уменьшается [γ(Хi) < 1] из-за увеличения межионного взаимодействия, а при увеличении концентрации раствора до 1 моль/л и выше, значение γ(Xi) возрастает и может даже превысить 1, то есть активность иона в растворе становится больше его истинной концентрации. Это объясняется тем, что в растворах с высокой концентрацией ионов не хватает воды для полной их гидратации, что резко увеличивает подвижность этих ионов, так как они конкурируют между собой за молекулы воды.
2. С повышением температуры γ(Хi) увеличивается, так как возрастает подвижность иона (Xi) не только за счёт увеличения скорости движения всех частиц в растворе, но и в результате частичного разрушения гидратного слоя вокруг этого иона.
3. На величину γ(Хi) влияет общая концентрация всех ионов в растворе. В связи с этим Г. Льюис (1907 г.) ввёл понятие ионной силы раствора электролита.
Ионная сила раствора (I) – величина, характеризующая интенсивность электростатического поля всех ионов в растворе, которая равна полусумме произведений молярной концентрации (ci) каждого иона на квадрат его заряда (zi):
I =  (3.3)
(3.3)
Определим взаимосвязь между ионной силой раствора электролита и его концентрацией в зависимости от числа и заряда ионов в формульной единице электролита*. Так, для электролита с однозарядными ионами, например NaCl (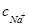 =
=  = с соли)
= с соли)
I =  .
.
Для электролита, содержащего двух- и трёхзарядные ионы, например A12(SO4)3 ( = 2ссоли,
= 2ссоли,  = 3ссоли):
= 3ссоли):
I =  .
.
Следовательно, ионная сила раствора сильно возрастает при наличии в нём многозарядных ионов.
|
|
|
В очень разбавленных растворах зависимость между коэффициентом активности иона γi, зарядом этого иона z iи ионной силой I описывается уравнением Дебая-Хюккеля:
 . (3.4)
. (3.4)
Из этого соотношения следует, что с увеличением ионной силы раствора коэффициент активности данного иона уменьшается. В практике значения коэффициентов активности ионов в растворах данной концентрации берут из справочных таблиц (табл. 2).
Таблица 2
|
|
|


