 |
Факторы, влияющие на степень электролитической диссоциации и константу электролитической диссоциации.
|
|
|
|
На степень диссоциации влияют следующие факторы:
1) Природа химической связи:
а) полярность
б) поляризуемость
Пример: степени диссоциации: CH3COOH – 0,014, HNO3 – 0,9; HF – 0,08; HI – 0,98
2) Свойства среды – диэлектрическая проницаемость. Чем выше значение диэлектрической проницаемости  , тем выше степень диссоциации.
, тем выше степень диссоциации.
Пример: Для C6H6 – 2.0; для C2H5OH – 27,8; для воды – 78,5; для крови – 85.
3) Концентрация раствора: с уменьшением концентрации степень диссоциации увеличивается
4) Температура: при повышении температуры степень диссоциации увеличивается.
На константу диссоциации влияют следующие факторы:
1) Природа вещества
2) Природа растворителя (с увеличением диэлектрической проницаемости увеличивается константа)
3) Температура (с увеличением температуры константа увеличивается)
Не зависит от концентрации
Закон разведения Оствальда.
Степень диссоциации обратно пропорциональна концентрации растворённого вещества
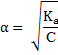
Закон применим для растворов слабых электролитов.
Билет 16. Основные положения теории растворов сильных электролитов Дебая-Хюккеля. Активность, коэффициент активности ионов. Ионная сила раствора. Кажущаяся степень диссоциации. Электролиты в организме.
Основные положения теории растворов сильных электролитов Дебая-Хюккеля (концепция межионного взаимодействия – 1923 г.)
- Электростатическое притяжение между ионами существует в растворах всех электролитов, но в слабых – незначительна
- Чем больше концентрация раствора, тем больше будет проявляться тормозящее действие ионной атмосферы
- Определяемая по электрической проводимости растворов степень диссоциации сильных электролитов не соответствует действительной степень распада электролита на ионы и является кажущейся.
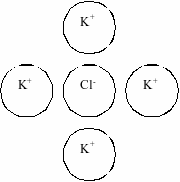 Ионная атмосфера
Ионная атмосфера
|
|
|
Активность, коэффициент активности ионов.
Активность иона – это та эффективная, условная его концентрация, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов (моль/л).

f – коэффициент активности ионов. Показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе. Значение f зависит от концентрации данного иона. Для концентрированных растворов f<1 из-за межионного взаимодействия. Для очень разбавленных растворов f близок к единице, так как действие межионных сил почти не проявляется вследствие увеличения расстояния между ионами. На величину f влияет общая концентрация всех ионов в растворе. Поэтому Г. Льюис ввёл понятие ионной силы раствора электролита.
Ионная сила раствора
Ионная сила раствора (I) – это мера интенсивности электрического поля, создаваемого всеми ионами в растворе. Ионная сила равна:

где I – ионная сила раствора,  – моляльные концентрации ионов, z – заряд иона.
– моляльные концентрации ионов, z – заряд иона.
Кажущаяся степень диссоциации.
 , где i – изотонический коэффициент, n – число ионов, на которые распадается электролит при диссоциации
, где i – изотонический коэффициент, n – число ионов, на которые распадается электролит при диссоциации
Для растворов сильных электролитов величина, вычисленная теоретически, не будет соответствовать действительной степени распада электролита на ионы.
Электролиты в организме.
Биологические жидкости и ткани содержат много различных электролитов: NaCl, KCl, HCl, CaCl2, NaH2PO4, NaHCO3 и др. Устойчивость биологических высокомолекулярных соединений и скорость многих биохимических реакций в значительной мере зависят от природы и концентрации присутствующих в жидкостях и тканях ионов.
Основные функции:
1) Поддержание осмотического давления в клетках, тканях, крови.
2) Поддержание кислотно-щелочного равновесия (буферные системы)
|
|
|
3) Участвуют в функционировании систем органов.
Электролиты выполняют в организме важную роль: отвечают за осмолярность и величину ионной силы биосред, образуют биоэлектрический потенциал, катализируют процессы обмена веществ, стабилизируют определенные ткани (костная), служат в качестве энергетических депо (фосфаты), участвуют в свертывающей системе крови и т.д.
Билет 17. Основные положения протолитической теории кислот и оснований Бренстеда-Лоури; сопряженная протолитическая пара. Связь между константой кислотности и константой основности в сопряженной протолитической паре. Амфолиты. Теория Льюиса.
|
|
|


