 |
Факторы, влияющие на устойчивость лиозолей.
|
|
|
|
· Толщина диффузного слоя (чем больше, тем меньше вероятность агрегации)
· Силы молекулярного притяжения
· Силы электростатического отталкивания
Повысить седиментационную устойчивость дисперсной системы можно за счет следующих факторов:
· 1) снижение силы тяжести: достигается путем уменьшения размера частиц с помощью устройств для дробления дисперсной фазы – диспергаторов (уменьшение диаметра частицы в 2 раза приводит к снижению силы тяжести в 8 раз)
· 2) повышение вязкости среды: достигается при введении различных добавок, повышающих вязкость (сиропы, желатин)
· 3) обеспечение хранения дисперсной системы при температуре, не ниже установленной нормы, так как при снижении температуры уменьшается броуновское движение, а, следовательно, и седиментационная устойчивость (например, если поставить вино в холодильник, может образоваться осадок).
Коагуляция.
Коагуляция – процесс разрушения коллоидных систем за счёт слипания частиц, образование более крупных агрегатов с потерей устойчивости и последующим разделением фаз.
Коагуляция золей происходит посредством следующих факторов:
· Механический – механической воздействие на коллоидный раствор – перемешивание, взбивание (частицы сталкиваются, слипаются и выпадают в осадок)
· Повышение температуры (увеличивается скорость движения частиц, они сталкиваются, происходит их коагуляция)
· Сильное охлаждение (противоионы прикрепляются к коллоидной частице, частицы слипаются и выпадают в осадок)
· Прибавление сильного электролита (заряды будут разряжаться ионами электролита). Коагуляцию золя вызывает тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы. Этот ион – ион-коагулятор. Минимальная концентрация электролита, по достижении которой начинается коагуляция, называется порогом коагуляции
|
|
|
Билет 27. Окислительно-восстановительные (редокс) реакции. Механизм возникновения электродного и редокс-потенциалов. Уравнения Нернста-Петерса. Сравнительная сила окислителей и восстановителей. Стандартный электродный потенциал. Гальванический элемент.
Окислительно-восстановительные (редокс) реакции
Окислительно-восстановительные реакции – химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
 Механизм возникновения электродного и редокс-потенциалов.
Механизм возникновения электродного и редокс-потенциалов.
При погружении Ме в раствор, содержащий ион этого же Ме, на поверхности раздела фаз образуется двойной слой и возникает скачок равновесного потенциала – электродный потенциал. Полученная система Ме+раствор называют электродом. Обозначение (на примере цинка)
Zn|Zn2+
Количественной характеристикой редокс-систем, в которых и окислитель, и восстановитель находятся в растворенном состоянии, является редокс-потенциал. Чем больше величина редокс-потенциала, тем сильнее окислитель и слабее сопряженный ему восстановитель. Сильный окислитель вступает в реакции с большим числом восстановителей, чем слабый, и/или вызывает более глубокое окисление восстановителей.
Уравнения Нернста-Петерса
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
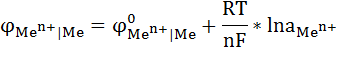
где  – электродный потенциал;
– электродный потенциал;  – стандартный электродный потенциал; R – универсальная газовая постоянная (8,31 Дж/моль*К); Т – абсолютная температура, К; n – число электронов участвующих в электронном процессе; F – постоянная Фарадея (96500 кл/моль); а – активность ионов металла в растворе 1 моль/л
– стандартный электродный потенциал; R – универсальная газовая постоянная (8,31 Дж/моль*К); Т – абсолютная температура, К; n – число электронов участвующих в электронном процессе; F – постоянная Фарадея (96500 кл/моль); а – активность ионов металла в растворе 1 моль/л
|
|
|
Уравнение Петерса – устанавливает количественную зависимость окислительно-восстановительного потенциала от природы ОВ-системы, соотношения активностей окисленной и восстановленной форм, температуры и от активности ионов водорода:

где  – ОВ-потенциал, В;
– ОВ-потенциал, В;  - стандартный ОВ-потенциал, В; z – число электронов, которое присоединяет частица окисленной формы Ox, переходя в восстановительную форму Red,
- стандартный ОВ-потенциал, В; z – число электронов, которое присоединяет частица окисленной формы Ox, переходя в восстановительную форму Red,  - активность окисленной формы, моль/л;
- активность окисленной формы, моль/л;  - активность восстановительной формы, моль/л;
- активность восстановительной формы, моль/л;
|
|
|


