 |
Адсорбционные равновесия и процессы на подвижных границах раздела фаз.
|
|
|
|
На поверхностях раздела фаз наблюдаются различные поверхностные явления: поверхностное натяжение, сорбция (включающая адсорбцию, абсорбцию), адгезия (слипание частиц жидкости с поверхностью тела в результате межмолекулярного взаимодействия), смачивание (адгезия>когезия), капиллярная конденсация (переход газа в жидкое и твёрдое состояние под действием повышенного давления). Все виды поверхностных явлений обусловлены тем, что частицы, находящиеся на поверхности раздела, по-разному взаимодействуют с частицами соприкасающихся фаз. Эти взаимодействия отличаются по энергии от взаимодействия частиц, соприкасающихся внутри каждой фазы. Подвижные границы раздела фаз наблюдаются между жидкостью и газом (ж-г), двумя несмешивающимися жидкостями (ж-ж).
Сорбция – это гетерогенный процесс самопроизвольного поглощения твёрдым телом или жидкостью веществ из окружающей среды. Твёрдые тела или жидкости, способные поглощать вещества, называют сорбентами, а поглощаемое вещество – сорбатом. Сорбция бывает обратимая и необратимая. В случае обратимой сорбции на границе раздела фаз устанавливается равновесие
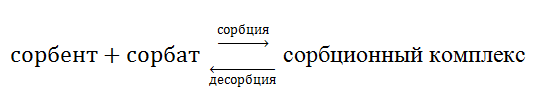
 если K>1, то преобладает сорбция, если меньше, то десорбция.
если K>1, то преобладает сорбция, если меньше, то десорбция.
Адсорбция – процесс сорбции, сопровождающийся концентрированием поглощаемого вещества на поверхности сорбента.
или
Адсорбция – самопроизвольное изменение концентрации растворённого вещества на границе раздела фаз.
Абсорбция – поглощаемые вещества (абсорбаты) в результате диффузии распределяются по всему объёму вещества-поглотителя (абсорбента)
 Поверхностная энергия Гиббса и поверхностное натяжение.
Поверхностная энергия Гиббса и поверхностное натяжение.
Силы межмолекулярного взаимодействия молекул, расположенных внутри жидкости, скомпенсированы. Молекулы, находящиеся на поверхности жидкости, испытывают неодинаковое воздействие со стороны молекул жидкости и пара. Равнодействующая этих сил направлена внутрь жидкости перпендикулярно границе раздела фаз в данной точке, площадь поверхности раздела жидкости стремится к уменьшению. Потенциальная энергия молекул жидкости на поверхности раздела фаз выше, чем у молекул внутри фазы. Эти отличия в энергетическом состоянии всех молекул поверхностного слоя характеризуются свободной поверхностной энергией GS
|
|
|
Свободная поверхностная энергия Гиббса – это термодинамическая функция, характеризующая энергию межмолекулярного взаимодействия частиц на поверхности раздела фаз с частицами каждой из соприкасающихся фаз.
Свободная поверхностная энергия зависит от количества частиц на поверхности раздела и прямо пропорциональная площади раздела фаз и удельной энергии межфазового взаимодействия.
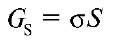
 – удельная свободная поверхностная энергия, характеризующая энергию межфазового взаимодействия единицы площади поверхности раздела фаз кДж/м2 . S – площадь поверхности раздела фаз, м2 . Для подвижных поверхностей раздела фаз
– удельная свободная поверхностная энергия, характеризующая энергию межфазового взаимодействия единицы площади поверхности раздела фаз кДж/м2 . S – площадь поверхности раздела фаз, м2 . Для подвижных поверхностей раздела фаз  называют коэффициентом поверхностного натяжения, который может быть охарактеризован как работа образования единицы поверхности.
называют коэффициентом поверхностного натяжения, который может быть охарактеризован как работа образования единицы поверхности.
При увеличении температуры поверхностное натяжение уменьшается, при достижении температуры кипения оно равно нулю. Оно также снижается при увеличении давления.
Все поверхностные явления происходят самопроизвольно, когда происходит убыль энергии Гиббса.
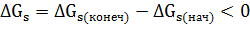

Самопроизвольное уменьшение свободной поверхностной энергии GS в однокомпонентных системах возможно только за счет уменьшения площади поверхности раздела фаз ( . Система стремится к минимальной площади при данном объёме, что соответствует форме сферы. В многокомпонентных системах уменьшение GS возможно также за счет уменьшения величины поверхностного натяжения ((
. Система стремится к минимальной площади при данном объёме, что соответствует форме сферы. В многокомпонентных системах уменьшение GS возможно также за счет уменьшения величины поверхностного натяжения (( в результате самопроизвольного перераспределения молекул компонента между объемом фазы и поверхностью раздела. К самопроизвольным поверхностным явлениям подобного рода относят также коалесценцию (слипание капель жидкости или пузырьков газа) и коагуляцию (слипание частиц в дисперсных системах)
в результате самопроизвольного перераспределения молекул компонента между объемом фазы и поверхностью раздела. К самопроизвольным поверхностным явлениям подобного рода относят также коалесценцию (слипание капель жидкости или пузырьков газа) и коагуляцию (слипание частиц в дисперсных системах)
|
|
|
Адсорбция
Адсорбция – процесс сорбции, сопровождающийся концентрированием поглощаемого вещества на поверхности сорбента.
или
Адсорбция – самопроизвольное изменение концентрации растворённого вещества на границе раздела фаз.
Абсорбция – поглощаемые вещества (абсорбаты) в результате диффузии распределяются по всему объёму вещества-поглотителя (абсорбента). Частный случай адсорбции.
В зависимости от природы сил, действующих между адсорбентом и адсорбатом различают физическую и химическую адсорбцию.
Если взаимодействие между адсорбатом и адсорбентом ограничивается межмолекулярным взаимодействием и является проявлением физических сил (индукционное, электростатическое взаимодействие; ван-дер-ваальсовы силы), то наблюдается физическая адсорбция. Она протекает на активных центрах, находящихся на впадинах рельефа поверхности (а) и носит обратимый характер. При повышении температуры она уменьшается. Если же в процессе взаимодействия проявляются химические силы (перераспределение электронной плотности, ионно-молекулярное взаимодействие), то наблюдается химическая адсорбция (хемосорбция).Она происходит на выступах микрорельефа поверхности (б). Хемосорбция носит специфический и необратимый характер. С повышением температуры химическая адсорбция увеличивается. Энергия связи при хемосорбции порядка 40-400 кДж/моль.
Адсорбция на границе жидкость-газ связана со свойствами растворённого вещества – уменьшать или увеличивать поверхностное натяжение на границе раздела фаз. Вещества, уменьшающие поверхностное натяжение и соответственное способствующие уменьшению энергии Гиббса (ПАВ), концентрируются преимущественно у поверхности раздела фаз. Вещества, повышающие поверхностное натяжение (ПИВ), накапливаются преимущественно в объёме фазы (концентрация выше, чем в поверхностном слое). Вещества, не влияющие на поверхностное натяжение (ПНВ), распределяются и по поверхностному слою, и по объёму фазы.
|
|
|
Г = n/m, где n – количество адсорбата, моль; m – масса адсорбента.
Уравнение Гиббса.
Адсорбцию на границе раздела жидкость-газ непосредственно не измеряют, а вычисляют с помощью уравнения Гиббса, которое выведено на основании 2-го начала термодинамики.
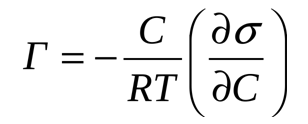
где Г – количество адсорбированного вещества, моль/м2 , с – молярная концентрация растворённого вещества, моль/л, R – газовая постоянная, 8,32 Дж/моль*К,  – поверхностная активность
– поверхностная активность
|
|
|


