 |
Адсорбция газов на твердых телах.
|
|
|
|
Адсорбция газов твёрдыми телами протекает с большой скоростью, поэтому адсорбционное равновесие устанавливается практически мгновенно.
При взаимодействии газа с адсорбентом наряду с адсорбцией, представляющей собой типично поверхностный процесс, может происходить поглощение газа или пара всем объёмом твёрдого тела, а также их конденсация в узких порах. Поглощение вещества всей массой адсорбента называется абсорбцией. Переход поглощаемого газа или пара в жидкое состояние (и даже твёрдое) в узких порах адсорбента называется капиллярной конденсацией (пример – раствор водорода в платине – твёрдый раствор).
Хемосорбция часто протекает только на поверхности сорбента. Например, при поглощении кислорода алюминием на поверхности металла образуется тонка плёнка оксида алюминия. Адсорбция газа на твёрдом теле измеряется количеством газа, адсорбированным единицей массы твёрдого тела (моль/кг или моль/г).
Адсорбция зависит от температуры, давления и природы адсорбата, удельной поверхности и природы адсорбента. На поверхности твёрдого тела при прочих равных условиях лучше  адсорбируются те газы, которые легче конденсируются в жидкость. Неполярные адсорбенты лучше адсорбируют неполярные органические соединения. Полярные адсорбаты лучше адсорбируются на поверхности ионных кристаллов. Адсорбция газов зависит от давления адсорбата. С ростом давления адсорбция возрастает до некоторого предельного значения. Адсорбция газов – экзотермический процесс. С ростом температуры адсорбция газов твёрдыми телами уменьшается.
адсорбируются те газы, которые легче конденсируются в жидкость. Неполярные адсорбенты лучше адсорбируют неполярные органические соединения. Полярные адсорбаты лучше адсорбируются на поверхности ионных кристаллов. Адсорбция газов зависит от давления адсорбата. С ростом давления адсорбция возрастает до некоторого предельного значения. Адсорбция газов – экзотермический процесс. С ростом температуры адсорбция газов твёрдыми телами уменьшается.
Адсорбция из растворов.
Неэлектролиты и слабые электролиты на поверхности адсорбента адсорбируются из растворов в виде молекул. Такой процесс называется молекулярной адсорбцией. В результате адсорбции концентрация растворённого вещества в растворе уменьшается. Адсорбцию определяют по разности концентраций исходного и равновесного растворов адсорбата.
|
|
|

где  – исходная концентрация адсорбата, моль/л; с – равновесная концентрация адсорбата, моль/л; V – объём раствора адсорбата, из которого происходила адсорбция, л; m – масса адсорбента, кг; a – адсорбция, моль/кг.
– исходная концентрация адсорбата, моль/л; с – равновесная концентрация адсорбата, моль/л; V – объём раствора адсорбата, из которого происходила адсорбция, л; m – масса адсорбента, кг; a – адсорбция, моль/кг.
 Адсорбция зависит от природы и концентрации адсорбента, температуры, природы адсорбента и растворителя, удельной поверхности адсорбента. С ростом концентрации раствора адсорбция на границе раздела твёрдое тело – раствор возрастает до некоторого предельного значения. При адсорбции ПАВ на границе раздела твёрдое тело – раствор, как и на границе раствор-газ, наблюдается различная ориентация молекул адсорбата. В системе полярный адсорбент – неполярный растворитель молекул адсорбата обращены полярной частью («головой») к поверхности адсорбента, а неполярная их часть («хвост») погружена в растворитель. В случае системы неполярный адсорбент – полярный растворитель, наоборот, неполярная часть молекулы обращена к поверхности адсорбента, а полярная часть погружена в растворитель.
Адсорбция зависит от природы и концентрации адсорбента, температуры, природы адсорбента и растворителя, удельной поверхности адсорбента. С ростом концентрации раствора адсорбция на границе раздела твёрдое тело – раствор возрастает до некоторого предельного значения. При адсорбции ПАВ на границе раздела твёрдое тело – раствор, как и на границе раствор-газ, наблюдается различная ориентация молекул адсорбата. В системе полярный адсорбент – неполярный растворитель молекул адсорбата обращены полярной частью («головой») к поверхности адсорбента, а неполярная их часть («хвост») погружена в растворитель. В случае системы неполярный адсорбент – полярный растворитель, наоборот, неполярная часть молекулы обращена к поверхности адсорбента, а полярная часть погружена в растворитель.
В системах полярный растворитель – малополярный адсорбент – адсорбция ПАВ подчиняется правилу Дюкло-Траубе. При адсорбции ПАВ из неполярных растворителей полярными адсорбентами выполняется обращённое правило Дюкло-Траубе: с ростом длины углеводородного радикала адсорбция увеличивается.
В растворах сильных электролитов ионы адсорбируются лишь на полярных и практически не адсорбируются на неполярных адсорбентах. На положительно заряженных участках поверхности адсорбента адсорбируются из раствора анионы, на отрицательно заряженных – катионы. Адсорбционная способность ионов на данной поверхности возрастает с увеличением их заряда. Адсорбционная способность больше у тех ионов, радиус которых в сольватированном состоянии меньше.
|
|
|
Уравнение Ленгмюра (изотерма Лэнгмюра):
Для подвижных поверхностей раздела фаз
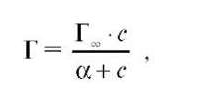
где Г - адсорбция, моль/г; Г∞ - предельная адсорбция: количество адсорбата, покрывающего поверхность адсорбента плотным монослоем. Характеризует адсорбционную способность адсорбента; α - константа адсорбционного равновесия, отражает способность адсорбата адсорбироваться; равна отношению констант скоростей десорбции и адсорбции; с - концентрация вещества в растворе, моль/л.
Для неподвижных поверхностей раздела фаз
Твёрдое тело - газ

где a – адсорбция при данных условиях, 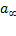 - предельная адсорбция (
- предельная адсорбция ( =константа адсорбционного равновесия), p – давление адсорбата
=константа адсорбционного равновесия), p – давление адсорбата
Твёрдое тело – раствор

где c – концентрация вещества в растворе.
Зависимость величины адсорбции от различных факторов. (уже сказано в предыдущих вопросах)
1. Природа фаз (предельная адсорбция, константа α). Кристаллические вещества адсорбируют хуже, чем аморфные. Лучше адсорбируются газы, которые легче конденсируются. Например, активированный уголь хорошо адсорбирует хлор (Ткип = 239,7 К), аммиак (Ткип = = 240 К), но не адсорбирует оксид углерода (II) (Ткип = 83 К), азот (Ткип = 77,0 К), водород (Ткип = = 20,0 К).
2. Давление. С увеличением давления адсорбция увеличивается до определённого значения.
3. Температура. Повышение температуры способствует понижению адсорбции и усилению десорбции.
|
|
|


