 |
Строение атома и химическая связь. Молекулярное взаимодействие. Кристаллическое состояние вещества
|
|
|
|
Электронное строение атома. Квантовые числа; s -, p -, d -, f -состояния электронов. Понятие о волновых свойствах электрона. Принцип Паули и его ограничения. Атомные электронные орбитали, порядок их заполнения. Правило В. М. Клечковского. Структура электронных оболочек атомов, энергетические ячейки. Правило Гунда. Основное и возбужденные состояния атома.
Периодический закон Д. И. Менделеева. Периодическая система элементов. Ряды, периоды, группы и подгруппы. Порядковый номер элемента. Периодичность некоторых свойств атомов – радиусов атомов, энергии ионизации, энергии сродства к электрону, электроотрицательности. Сходство и различие химических и физических свойств элементов и их соединений в подгруппах и периодах, кислотно-основные и окислительно-восстановительные свойства. Положение металлов, неметаллов и полупроводников в периодической системе элементов.
Общие представления о природе химической связи. Ковалентная связь. Ионная связь как предельный случай ковалентной полярной связи. Энергия и длина связи. Метод валентных связей (МВС). Понятие валентности с точки зрения МВС. Зависимость валентных возможностей элементов от их положения в Периодической системе. Понятие о методе молекулярных орбиталей.
Направленность ковалентных связей. Теория гибридизации валентных атомных орбиталей Л. Полинга. sp -, sp 2-, sp 3-гибридизации. Строение молекул.
Полярность химической связи. Дипольный момент двухцентровой связи и молекулы в целом.
Донорно-акцепторная связь и комплексные соединения. Водородная связь. Металлическая связь.
Межмолекулярное взаимодействие.
Общая характеристика агрегатных состяний вещества. Кристаллическое, аморфное и стеклообразное состояния. Монокристалл и поликристаллическое тело. Полиморфизм, аллотропия. Энантиоморфизм. Закон анизотропии. Закон построения междугранных углов.
|
|
|
Строение кристаллов, их классификация по симметрии внешней формы и по симметрии внутреннего строения. Пространственная и кристаллическая решетки. Элементарная ячейка. Основные типы кубических и гексагональных решеток. Координационное число, кратность, базис.
Плотность упаковки частиц в кристаллах. Плотнейшие упаковки. Междоузлия и их роль в процессах, протекающих в кристаллах.
Виды связи между частицами в кристаллах.
Реальные кристаллы. Точечные и протяженные дефекты. Влияние дефектов на свойства твердых тел. Современное толкование стехиометрических законов постоянства состава и простых кратных соотношений.
Пример 1. Составить электронную формулу элемента с порядковым номером 82. По форме записи определить, в каком периоде и группе находится данный элемент и какому семейству он принадлежит. Составить графическую схему заполнения электронами валентных орбиталей атома этого элемента в нормальном и возбужденном состояниях.
Решение. Согласно правилу Клечковского составляем электронную формулу элемента: 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 24 f 145 d 106 p 2. Этот элемент – Pb, находится в 6 периоде (n = 6), IV группе (на последнем уровне 4 электрона), принадлежит p -семейству (последние электроны заполняют p -подуровень). Валентные орбитали в этом атоме – орбитали внешнего (шестого) уровня, 6 s 26 p 2– электроны, определяющие химические свойства и валентность элемента. В основном состоянии графическая схема их заполнения имеет вид:
6 s 2 6 p 2
  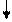 
|
В возбужденном состоянии один из 6 s -электронов может быть переведен на вакантную 6 p -орбиталь:
6 s 1 6 p 3
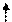   
|
Пример 2. Пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Н–О и О–Rb в гидроксиде RbОН и определить:
|
|
|
– какая из связей в молекуле характеризуется большей степенью ионности;
– каков характер диссоциации этих молекул в водном растворе.
Решение. По данным табл. 1 вычисляем разность относительных электроотрицательностей для связей О–Н и О–Rb: DcО–Н= 3,5 – 2,1 = 1,4, DcО–Rb= 3,5 – 0,8 = 2,7. Связь О – Rb более полярна и характеризуется большей степенью ионности. Диссоциация на ионы в водных растворах будет осуствляться по наиболее ионной связи в соответствии со схемой:
Rb(OH) «Rb++ OH–,
то есть по типу оснований.
Пример 3. Как изменяется прочность связи в ряду СO2–SiO2–GeO2–SnO2? Указать причины этих изменений.
Решение. В указанном ряду размеры валентных электронных облаков элементов (C, Si, Ge, Sn) возрастают, что приводит к уменьшению степени их перекрывания с электронным облаком кислорода и к возрастающему удалению области перекрывания от ядра атома соответствующего элемента. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т. е. ослабление связи. С другой стороны, возрастающее экранирование ядер рассматриваемых элементов в ряду С–Si–Ge–Sn вследствие увеличения числа промежуточных электронных слоев также приводит к уменьшению прочности связи.
Индивидуальные задания
Условие задания (а) подробно сформулировано в первом варианте, поэтому в последующих вариантах дается в сокращенном виде.
2.1. а) Составьте электронную формулу атома Al и графическую схему заполнения электронами валентных орбиталей этого атома в нормальном и возбужденном состояниях;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей K–Cl, Ge–Cl. Какая из связей характеризуется большей степенью ионности?
2.2. а) Атом P;
б) какой характер имеют связи в молекулах NCl3и CS2? Указать для каждой из них направление смещения общей электронной пары.
2.3. а) Атом Ca;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Н–О и О–Cl в гидроксиде ClОН и определить:
- какая из связей в молекуле характеризуется большей степенью ионности;
|
|
|
- каков характер диссоциации этих молекул в водном растворе.
2.4. а) Атом Ti;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей H–O и Al–O. Какая из связей более полярна? К какому классу гидроксидов относится Al(OH)3?
2.5. а) Атом Sc;
б) как изменяется прочность связи в ряду HF–HCl–HBr–HI? Указать причины этих изменений.
2.6. а) Атом Mg;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Ca–F, Mg–F. Какая из связей характеризуется большей степенью ионности?
2.7. а) Атом V;
б) какой характер имеют связи в молекулах NН3и ClF? Указать для каждой из них направление смещения общей электронной пары.
2.8. а) Атом S;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Н–О и О–K в гидроксиде KОН и определить:
– какая из связей в молекуле характеризуется большей степенью ионности;
– каков характер диссоциации этих молекул в водном растворе.
2.9. а) Атом Mn;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей H–O и В–О. Какая из связей более полярна? К какому классу гидроксидов относится В(OH)3?
2.10. а) Атом Zn;
б) как изменяется прочность связи в ряду LiCl–NaCl–KCl–RbCl? Указать причины этих изменений.
2.11. а) Атом Co;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Na–O, Ca–O. Какая из связей характеризуется большей степенью ионности?
2.12. а) Атом As;
б) какой характер имеют связи в молекулах ICl5и OF2? Указать для каждой из них направление смещения общей электронной пары.
2.13. а) Атом Ni;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Н–О и О–Br в гидроксиде BrОН и определить:
– какая из связей в молекуле характеризуется большей степенью ионности;
– каков характер диссоциации этих молекул в водном растворе.
2.14. а) Атом Ge;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей H–O и As–О. Какая из связей более полярна? К какому классу гидроксидов относится As(OH)3?
|
|
|
2.15. а) Атом Sr;
б) как изменяется прочность связи в ряду H2О–H2S–H2Se–H2Te? Указать причины этих изменений.
2.16. а) Атом Ga;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Li–Cl, Al–Cl. Какая из связей характеризуется большей степенью ионности?
2.17. а) Атом Se;
б) какой характер имеют связи в молекулах NF3и CO2? Указать для каждой из них направление смещения общей электронной пары.
2.18. а) Атом Cl;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Н–О и О–Na в гидроксиде NaОН и определить:
– какая из связей в молекуле характеризуется большей степенью ионности;
– каков характер диссоциации этих молекул в водном растворе.
2.19. а) Атом Zr;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей H–O и Sn–О. Какая из связей более полярна? К какому классу гидроксидов относится Sn(OH)2?
2.20. а) Атом Y;
б) как изменяется прочность связи в ряду BeH2–MgH2–CaH2–SrH2? Указать причины этих изменений.
2.21. а) Атом Tc;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Na–Br, Al–Br. Какая из связей характеризуется большей степенью ионности?
2.22. а) Атом Cd;
б) какой характер имеют связи в молекулах H2S и SiO2? Указать для каждой из них направление смещения общей электронной пары.
2.23. а) Атом Sn;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Н–О и О–I в гидроксиде IОН и определить:
– какая из связей в молекуле характеризуется большей степенью ионности;
– каков характер диссоциации этих молекул в водном растворе.
2.24. а) Атом Te;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей H–O и О–Sb. Какая из связей более полярна? К какому классу гидроксидов относится Sb(OH)3?
2.25. а) Атом Sb;
б) как изменяется прочность связи в ряду MgO–CaO–SrO–BaO? Указать причины этих изменений.
2.26. а) Атом Ba;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Be–O, Ge–O. Какая из связей характеризуется большей степенью ионности?
2.27. а) Атом Cr;
б) какой характер имеют связи в молекулах AsH3и SiO2? Указать для каждой из них направление смещения общей электронной пары.
2.28. а) Атом Ag;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Н–О и О–Rb в гидроксиде RbОН и определить:
– какая из связей в молекуле характеризуется большей степенью ионности;
– каков характер диссоциации этих молекул в водном растворе.
|
|
|
2.29. а) Атом Nb;
б) пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей H–O и О–Ge. Какая из связей более полярна? К какому классу гидроксидов относится Ge(OH)2?
2.30. а) Атом In;
б) как изменяется прочность связи в ряду NH3–PH3–AsH3–SbH3? Указать причины этих изменений.
|
|
|


