 |
Коррозия металлов и методы защиты от нее
|
|
|
|
Окислительно-восстановительные реакции (ОВР) и их роль в электрохимических процессах. Ионно-электронный метод уравнивания ОВР.
Возникновение скачка потенциала на границе «металл – раствор». Равновесный электродный потенциал.
Водородный электрод. Понятие о стандартных потенциалах. Ряд напряжений. Типы электродов и цепей.
Теория гавльванического элемента. Электродвижущая сила и напряжение разряда. Формула Нернста.
Электролиз. Последовательность разряда ионов на электродах. Анодные и катодные процессы. Количественные законы электролиза (законы Фарадея). Выход по току. Явление поляризации при электролизе. Напряжения разложения и перенапряжения.
Типы химических источников электрической энергии. Гальванические элементы Диниэля-Якоби и Лекланше, кислотный и щелочной аккумуляторы, топливные элементы.
Коррозия металлов. Химическая кор р озия: газовая и жидкостная. Электрохимическая коррозия (микро- и макрогальванокоррозия). Условия, влияющие на электрохимическую коррозию. Атмосферная, почвенная коррозия, коррозия под влиянием блуждающих токов, электрокоррозия.
Методы защиты от коррозии. Защитные пленки на поверхности металлов. Металлические покрытия. Неметаллические покрытия. Ингибиторы коррозии. Электрозащита, протекторная защита.
Пример 1. Закончить и уравнять ионно-электронным методом окислительно-восстановительную реакцию, протекающую в кислой среде:
KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + …
Решение. Данное уравнение реакции перепишем в ионной форме:
K+ + I– + 2K+ + Cr2O72– + 2H+ + SO42– → I2 + 2Cr3+ + 3 SO42– + …
и определим для восстановителя его окисленную форму
I– → I2,
а для окислителя − его восстановленную форму
|
|
|
Cr2O72– → 2Cr3+.
Для процессов окисления и восстановления необходимо сначала осуществить материальный баланс с помощью ионов H+и молекул H2O, а затем баланс по электрическим зарядам. Полученные два уравнения следует просуммировать, умножив каждое из них на коэффициенты, подобранные так, чтобы число электронов, теряемых восстановителем, было равно числу электронов, приобретаемых окислителем. В результате получаем ионное уравнение окислительно-восстановительной реакции:
 3 2 I– − 2ē → I2
3 2 I– − 2ē → I2
1 Cr2O72– + 14 H+ + 6ē → 2 Cr3+ + 7H2O
6 I– + Cr2O72– + 14 H+ → 3 I2 + 2 Cr3+ + 7H2O.
Остается коэффициенты из ионного уравнения перенести в молекулярное уравнение реакции и уравнять ионы, не участвовавшие в окислительно-восстановительной схеме (K+и SO42–):
6KI + K2Cr2O7 + 7 H2SO4 → 3I2 + Cr2(SO4)3+ 4K2SO4 + 7H2O.
Пример 2. Закончить и уравнять ионно-электронным методом окислительно-восстановительную реакцию, протекающую в щелочной среде:
Bi2O3 + Br2 + KOH → K3BiO4 + KBr + …
Решение. Перепишем данное уравнение реакции в ионной форме:
Bi2O3 + Br2 + K+ + OH– → 3K+ + BiO43– + K+ + Br– + …
и определим для восстановителя его окисленную форму
Bi2O3 → BiO43–,
а для окислителя − его восстановленную форму
Br2 → Br–.
Для процессов окисления и восстановления необходимо сначала осуществить материальный баланс с помощью ионов OH– и молекул H2O, а затем баланс по электрическим зарядам. Далее – аналогично предыдущему примеру. В результате получаем ионное уравнение окислительно-восстановительной реакции:
 1 Bi2O3 + 10OH– − 4ē → 2 BiO43– + 5 H2O
1 Bi2O3 + 10OH– − 4ē → 2 BiO43– + 5 H2O
2 Br2 + 2ē → 2Br–
Bi2O3 + 2Br2 +10OH–→ 2BiO43– + 4Br– + 5 H2O.
Коэффициенты из ионного уравнения перенесем в молекулярное уравнение реакции и проверим, уравнялись ли при этом ионы, не принимавшие участия в окислительно-восстановительной схеме (K+):
Bi2O3 + 2Br2 + 10KOH → 2 K3BiO4 + 4KBr + 5 H2O.
Пример 3. Написать уравнения реакций, происходящих при работе ГЭ (гальванического элемента), состоящего из цинковой и серебряной пластин, погруженных в растворы своих солей с клнцентрацией катионов, равной 1 моль/л.
|
|
|
Решение. Стандартные электродные потенциалы цинкового и серебряного электродов соответственно равны:
j°Zn0 / Zn2+= –0,76 В; j°Ag0 / Ag+= +0,80 В.
Металл, имеющий более отрицательное значение электродного потенциала при работе ГЭ, является анодом. В данном случае протекают реакции:
Zn0 – 2ē ® Zn2+
Ag+ + ē ® Ag0,
то есть цинк, являясь анодом, растворяется при работе ГЭ, а серебро осаждается в виде металла на катоде,
ЭДС = j°катода– j°анода= j°Ag0 / Ag+– j°Zn0 / Zn2+= +0,80 – (–0,76) = 1,56 В.
Пример 4. Рассчитать, чему равна ЭДС элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей, если концентрация катиона у анода 0,1 моль/л, а у катода 0,001 моль/л.
Решение. Стандартные электродные потенциалы магниевого и медного электродов соответственно равны:
j°Mg0 / Mg2+= –2,38 В; j°Cu0 / Cu2+= +0,34 В.
Следовательно, анодом будет магниевый электрод, катодам – медный. Электродный потенциал металла, опущенный в раствор с любой концентрацией катиона в растворе, определяют по формуле Нернста:
j = j° + 0,058/ n lg с =
где с – концентрация катиона, моль/л; n – степень окисления.
Отсюда потенциал магниевого электрода
j = j° + 0,058/2 lg 10–1= –2,38 + 0,0029. (–1) = –2,409 В.
Потенциал медного электрода равен
j = +0,34 + 0,058/2 lg 10–3= +0,34 + 0,0029. (–3) = +0,253 В.
Тогда для ГЭ:
ЭДС = jокисл– jвосст= jCu0 / Cu2+– jMg0 / Mg2+= +0,253 – (–2,409) = 2,662 В.
Пример 5. Исходя из величины стандартных электродных потенциалов и значения энергии Гиббса D G °298, указать, возможно ли в ГЭ осуществление следующей реакции: Fe0+ Cd2+⇄ Fe2++ Cd0.
Решение. Составим схему ГЭ, отвечающего данной реакции. В этой реакции происходит восстановление ионов кадмия и окисление атомов железа:
Fe0– 2ē ® Fe2+
Cd2++ 2ē ® Cd0,



|
Пользуясь таблицей стандартных электродных потенциалов (приложение 3), определяем ЭДС этого ГЭ:
ЭДС = j°окисл– j°восст= j°Cd0 / Cd2+– j°Fe0 / Fe2+= –0,40 – (–0,44) = 0,04 В.
Изменение величины энергии Гиббса с величиной ЭДС связано соотношением:
D G °298= – nFE,
где n – число электронов, принимающих участие в реакции; F – число Фарадея. Находим
|
|
|
D G °298= –2. 96500. 0,04 = – 7720 Дж.
Так как Е ° > 0, D G °298< 0, следовательно, данную реакцию можно осуществить в ГЭ. Реакция в прямом направлении идет самопроизвольно.
Пример 6. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если пара металлов находится в кислой среде (в HCl)? Привести схему образующегося при этом ГЭ.
Решение. Исходя из положения металлов в ряду напряжений, то есть сравнивая величины стандартных электродных потенциалов, видим, что хром является более авктивным металлом (j°Cr0 / Cr3+= –0,744 В) и в образующейся гальванической паре хром будет анодом. Медь является катодом (j°Cu0 / Cu2+= = +0.337 В). Хромовый анод растворяется (окисляется хром), а на медном катоде выделяется водород.
Схема работающего при коррозии ГЭ:
 |
|
Пример 7. Определить массу выделившихся на электродах веществ при электролизе раствора сульфата кадмия CdSO4в течение 3 ч током силой 2.5 A. Выход по току на катоде 76 %. Написать электродные процессы, протекающие на электродах при электролизе с угольным анодом.
Решение. На электродах протекают следующие реакции:
на катоде: Cd2+ + 2ē = Cd;
на аноде: 2H2O – 4ē = O2 + 4H+.
Масса выделившегося на катоде кадмия с учетом выхода по току определяется по формулам:
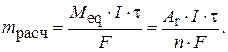

где M eq – эквивалентная масса металла; A r – атомная масса металла; n – валентность металла; I – сила тока, проходящего через раствор, A; τ – время электролиза, ч; 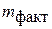 – масса металла, фактически выделившегося на катоде, г.
– масса металла, фактически выделившегося на катоде, г.
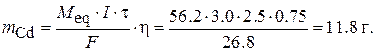
Масса выделившегося на аноде кислорода определяется по тем же формулам:
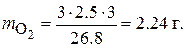
Индивидуальные задания
Условие задания (а) подробно сформулировано в первом варианте, поэтому в последующих вариантах дается в сокращенном виде.
7.1. а) Уравнять ионно-электронным методом окислительно-восстановительную реакцию:
NaCrO2+ Br2+ NaOH ® Na2CrO4+ NaBr + H2O.
б) Написать уравнения реакций, происходящих при работе ГЭ, составленного из медной и магниевой пластин, опущенных в растворы своих солей с концентрацией катионов 1 моль/л. Определить ЭДС этого элемента.
|
|
|
7.2. а) H2MnO4 ® MnO2+ HMnO4+ H2O.
б) Никелевое изделие покрыто серебром. Какой из металлов будет окисляться при коррозии в случае разрушения поверхности покрытия? Составить схему образующегося при этом ГЭ, помня, что коррозия идет во влажном воздухе, содержащем СО2.
7.3. а) H2S + HNO3 ® S + NO2+ H2O.
б) При рафинировании меди (электролиз раствора CuSO4с растворимым медным анодом) током силой 50 А в течение 4 ч выделилось 224 г меди. Определить выход по току.
7.4. а) Cl2+ KOH ® KClO + KCl + H2O.
б) Написать схему процесса электролиза водного раствора сульфата меди и рассчитать объем водорода (н. у.), выделившегося на аноде, если на катоде за это же время выделилост 0,318 г меди.
7.5. а) FeSO4+ HNO3 ® Fe(NO3)3+ NO2+ H2SO4+ H2O.
б) В каком направлении будет протекать реакция (значения Red–Ox-потенциалов см. в приложении 3): KI + FeCl3 ® FeCl2+ KCl + I2?
7.6. а) HJ + H2SO4 ® J2+ H2S + H2O.
б) Какие процессы происходят на электродах ГЭ, образованного железом, погруженным в раствор его соли с концентрацией Fe2+10–3моль/л, и серебром, погруженным в раствор его соли? Оделить концентрацию ионов Ag+в растворе его соли, если ЭДС этого элемента 1,152 В.
7.7. а) Ag + H2SO4 ® Ag2SO4+ SO2+ H2O.
б) Какое время потребуется для выделения всей меди из 40 мл 0,25 н. раствора CuSO4? Сила тока 1,93 A.
7.8. а) HClO4+ SO2+ H2O ® HCl + H2SO4.
б) Железо находится в контакте с цинком в сернокислой среде. Какой из металлов будет разрушаться в этих условиях? Рассчитать ЭДС и D G °298образующегося ГЭ, написать уравнения реакций катодного и анодного процессов.
7.9. а) H2S + HClO ® S + HCl + H2O.
б) Сколько граммов меди выделится на катоде при пропускании через раствор CuSO4тока силой 8 А в течение 10 мин. Выход по току 80 %.
7.10. а) NaBrO3+ H2SO4+ NaBr ® Br2+ Na2SO4+ H2O.
б) Возможна ли реакция между KСlO3и MnO2в кислой среде (значения Red–Ox-потенциалов см. в приложении 3)?
7.11. а) K2MnO4+ H2O ® MnO2+ KMnO4+ KOH.
б) При электролизе соли некоторого металла за 2 ч 24 мин 45 с при силе тока 8 А на катоде выделилось 6,48 г этого металла. Вычислить молярную массу эквивалента этого металла.
7.12. а) J2+ H2O ® HJO3+ HJ.
б) Написать процессы, протекающие при электрохимической коррозии железа, покрытого кадмием. Среда слабощелочная.
7.13. а) H2S + SO2 ® S + H2O.
б) При электролизе водного раствора Ni(NO3)2, проводимом током 3 A, выделилось 35 г металла. В течение того же времени велся электролиз водного раствора ZnCl2током 2 A. Найти массу выделившегося цинка. Написать электродные процессы, протекающие при электролизе этих солей. Аноды растворимые.
7.14. а) H2SO3+ Cl2+ H2O ® H2SO4+ HCl.
б) В каком направлении будет протекать реакция (значения Red–Ox-потенциалов см. в приложении 3): CuS + H2O2+ HCl = CuCl2+ S + H2O?
7.15. а) Cr2O3+ NaNO3+ NaOH ® Na2CrO4+ NaNO2+ H2O.
б) Какие процесы происходят на электродах при электролизе раствора хлорида никеля (II), если оба электрода сделаны из никеля? Как изменится масса анода после пропускания тока силой 3,2 А в течение 30 мин?
|
|
|
7.16. а) Fe2O3+ KNO3+ KOH ® K2FeO4+ KNO2+ H2O.
б) Электролизер содержит раствор нитрата свинца (II), анод – свинцовый. Продолжительность электролиза 2 ч 40 мин 50 с, сила тока 5 А. Вычислить теоретическую убыль в весе свинцового анода.
7.17. а) HBr + H2SO4 ® Br2+ SO2+ H2O.
б) Можно ли при стандартных условиях окислить в щелочной среде Fe2+в Fe3+с помощью хромата калия K2СrO4 (значения Red–Ox-потенциалов см. в приложении 3)?
7.18. а) HNO2+ H2S ® NO + S + H2O.
б) Какова эквивалентная концентрация раствора AgNO3, если для выделения всего серебра из 0,065 л этого раствора потребовалось пропустить ток силой 0,6 А в течение 20 мин? Электролиз раствора нитрата серебра идет на графитовых электродах. Привести полную схему электролиза.
7.19. а) Mn + HNO3 ® Mn(NO3)2+ NO + H2O.
б) Найти массу продуктов, выделившихся на электродах при электролизе водного раствора KOH в течение 1 ч при токе 2 A. Выход по току 90 %. Написать электродные процессы. Анод платиновый.
7.20. а) Br2+ Cl2+ H2O ® HBrO3+ HCl.
б) Для получения 1 м3хлора при электролизе водного раствора хлорида магния было пропущено через раствор 2432 А. ч электричества. Вычислить выход по току. Привести полную схему электролиза раствора MgCl2с применением графитовых электродов.
7.21. а) Mn + H2SO4 ® SO2+ MnSO4+ H2O.
б) Написать процессы, идущие при электрохимической коррозии в слабощелочном водном растворе контактирующей пары металлов  .
.
7.22. а) HJ + H2SO4 ® J2+ S + H2O.
б) Ток силой в 5 A проходил в течение 1 ч через разбавленный раствор H2SO4. Вычислить массу разложившейся воды и объемы Н2и O2, выделившихся на электродах при н. у.
7.23. а) HCl + HClO3 ® Cl2+ H2O.
б) Анодное окисление сульфата хрома (III) протекает по уравнению
Cr2(SO4)3+ 4 H2O + 3/2 O2= H2Cr2O7+ 3 H2SO4. Сколько ампер-часов электричества потребуется для получения таким путем 1 кг дихромовой кислоты при выходе по току 45 %?
7.24. а) HNO3+ HCl ® Cl2+ NO + H2O.
б) Вычислить ЭДС гальванического элемента, образованного кадмиевым электродом, погруженным в 0,001 М раствор CdSO4, и цинковым электродом, погруженным в 0,002 М раствор ZnSO4, если степень диссоциации этих электролитов при данных концентрациях равна 80 %.
7.25. а) H2S + H2SO3 ® S + H2O.
б) Исходя из величин D G °298, определить, какие из приведенных металлов – магний, медь, золото – будут подвергаться коррозии во влажном воздухе. Процесс идет по уравнению Ме + Н2О + О2= Ме(ОН) n.
7.26. а) Na2SO3+ KMnO4+ H2O ® Na2SO4+ MnO2+ KOH.
б) В каком направлении будет протекать реакция (значения Red–Ox-потенциалов см. в приложении 3):
CrCl3+ Br2+ KOH ® K2СrO4+ KBr + H2O + KCl?
7.27. а) K2Cr2O7+ H2SO4+ K2SO3 ® Cr2(SO4)3+ K2SO4+ H2O.
б) Через раствор сульфата магния пропустили ток силой 5,2 А в течение 18 мин. Какие вещества выделяются на электродах и каков объем газообразных продуктов (н. у.)? Привести полную схему электролиза.
7.28. а) Cu + HNO3® Cu(NO3)2+ NO + H2O.
б) При электролизе током силой 4 А в течение 40 мин на катоде выделилось 9,084 г металла. Вычислить электрохимический эквивалент этого металла в г/(А. ч).
7.29. а) Br2+ SO2+ H2O ® HBr + H2SO4.
б) Железо покрыто никелем. Какой из металлов будет корродировать в случае разрушения никелевого покрытия (коррозия происходит в кислой среде)? Составить схему ГЭ, образующегося при этом, написать уравнения реакций катодного и анодного процессов.
7.30. а) Cu + H2SO4 ® CuSO4+ SO2+ H2O.
б) Какие процессы происходят у электродов магниевого концентрационного ГЭ, если у одного из электродов концентрация ионов Mg2+равна 1 моль/л, а у другого 10–3моль/л? По какому направлению движутся электроны по внешней цепи? Рассчитать ЭДС этого элемента.
Список рекомендуемой литературы
Глинка Н.Л. Общая химия. М.: Химия, 1988.
Глинка Н.Л. Задачи и упражнения по общей химии. М.: Интеграл-Пресс, 2003.
Курс химии / Под ред. Н. В. Коровина. 2-е изд., М.: Высш. шк., 2001.
Харин А. Н., Катаева Н. А., Харина А. Т. Курс химии. М.: Высш. шк., 1983.
Суворов А.В., Никольский А.Б. Общая химия. СПб: Химия, 1994.
Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М.: Химия, 1994.
ПРИЛОЖЕНИЯ
1. Относительная электроотрицательность элементов
| I | II | III | IV | V | VI | VII | VIII |
| H 2,1 | |||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | |
| K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Fe Co Ni 1,9 1,9 1,9 |
| Zn 1,6 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 | ||
| Rb 0,8 | Sr 1,0 | Y 1,2 | Zr 1,5 | Nb 1,6 | Mo 1,8 | Tc 1,9 | Ru Rh Pd 2,2 2,2 2,2 |
| Cd 1,7 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 | ||
| Cs 0,7 | Ba 0,9 | La–lu 1,0–1,2 | Hf 1,3 | Ta 1,5 | W 1,7 | Re 1,9 | Os Ir Pt 2,2 2,2 2,2 |
| Hg 1,9 | Pb 1,9 | Bi 1,9 | Po 2,0 | At 2,2 | |||
| Fr 0,7 | Ra 0,9 |
2. Стандартные энтальпии образования
и стандартные энтропии некоторых веществ при 298 К (25 °С)
| Вещество | D H о298, кДж/моль | S о298, Дж/(моль.К) | D ср Дж/(моль.К) | Вещество | D H о298, кДж/моль | S о298, Дж/(моль.К) | D ср Дж/(моль.К) |
| Ag (кр) | 42,7 | 25,5 | H2O (ж) | –285,8 | 70,0 | 75,3 | |
| AgNO3(кр) | –120,7 | 140,9 | 93,1 | H2S (г) | –20,1 | 205,6 | 33,9 |
| Al (кр) | 28,3 | 24,1 | HI (г) | –25,9 | 206,3 | 29,2 | |
| Al2O3(кр) | –1675,0 | 50,9 | 79,0 | Mg (кр) | 32,6 | 24,8 | |
| Ba(NO3)2(кр) | –979,0 | 214,1 | 151,2 | MgO (кр) | –601,2 | 26,9 | 37,4 |
| BaO (кр) | –556,6 | 70,3 | 47,0 | N2 (г) | 191,5 | 29,1 | |
| CH3OH (г) | –201,2 | 239,7 | 43,9 | NH3 (г) | –46,2 | 192,5 | 35,7 |
| CH4 (г) | –74,9 | 186,2 | 35,8 | NH4NO3(кр) | –365,4 | 151,0 | 139,1 |
| C2H4 (г) | 52,3 | 219,4 | 43,6 | N2O (г) | 81,6 | 220,0 | 39,0 |
| CO (г) | –110,5 | 197,4 | 29,2 | NO (г) | 90,4 | 210,6 | 29,8 |
| CO2 (г) | –393,5 | 213,6 | 37,1 | NO2 (г) | 33,9 | 240,5 | 37,1 |
| CS2 (ж) | 115,3 | 237,8 | 76,0 | Na2CO3(кр) | –1129,0 | 146,0 | 110,0 |
| Ca (кр) | 41,6 | 25,1 | NaOH (кр) | –426,6 | 64,2 | 59,7 | |
| CaCO3(кр) | –1206,0 | 92,9 | 81,9 | Ni (кр) | 30,2 | 26,1 | |
| CaO (кр) | –635,1 | 39,7 | 43,8 | NiO (кр) | –239,7 | 38,0 | 44,2 |
| Cl2 (г) | 223,0 | 38,8 | O2 (г) | 205,0 | 29,4 | ||
| CuCl2(кр) | –205,9 | 113,0 | 80,1 | PbO | –217,9 | 67,4 | 46,0 |
| CuO (кр) | –165,3 | 42,6 | 44,9 | PbS (кр) | –94,3 | 91,2 | 35,0 |
| Fe (кр) | 27,2 | 25,2 | S (ромб) | 31,9 | 22,6 | ||
| FeO (кр) | –263,7 | 58,8 | 48,1 | S2 (г) | 129,1 | 227,7 | 32,5 |
| Fe2O3(кр) | –812,3 | 90,0 | 103,7 | SO2 (г) | –296,9 | 248,1 | 39,9 |
| Fe3O4(кр) | –1117,5 | 151,5 | 143,4 | Sb (кр) | 46,2 | 25,1 | |
| FeS (кр) | –101,0 | 60,1 | 51,2 | Sb2S3 | –158,3 | 182,2 | 118,0 |
| H2 (г) | 130,6 | 28,8 | I2 (г) | 116,7 | 54,4 | ||
| HCl (г) | –92,3 | 186,7 | 29,2 | V (кр) | 29,0 | 25,3 | |
| H2O (г) | –241,8 | 188,7 | 33,6 | V2O5(кр) | –1550,1 | 131,3 | 130,2 |
|
|
|


