 |
Кинетика химических реакций. Катализ
|
|
|
|
Понятие о скорости химической реакции. Закон действия масс для скорости реакции. Молекулярность и порядок реакции.
Зависимость скорости от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Активные молекулы, энергия активации. Графический и аналитический методы расчета энергии активации. Кинетика гетерогенных процессов.
Явление катализа. Сущность гомогенного и гетерогенного катализа. Ингибиторы.
Пример 1. Как изменится скорость реакции 2 NO (г)+ O2 (г)= 2 NO2 (г), если общее давление в системе уменьшить в 5 раз?
Решение. Уменьшение давления в системе в 5 раз вызовет увеличение объема системы в 5 раз, а концентрация реагирующих веществ при этом уменьшается в 5 раз.
Начальная скорость реакции равна: v 1= k с 2NO с O2.
В результате уменьшения давления в 5 раз:
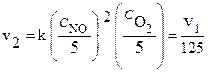
Пример 2. В какую сторону сместится равновесие в реакции:
CO2 (г) + C (тв) = 2 CO (г); D H ° > 0
а) при повышении температуры; б) при увеличении давления? Напишите выражение для константы равновесия.
Решение. Согласно принципу Ле-Шателье при повышении температуры равновесие сместится в сторону эндотермической реакции, т. е. вправо. При увеличении давления равновесие сместится влево, в сторону уменьшения в системе числа молекул газообразных веществ (уменьшения объема). Выражение для константы равновесия имеет вид 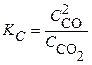 .
.
Пример 3. Реакция в газовой фазе протекает по уравнению: А + В «2 С. Определить равновесные концентрации реагирующих веществ, если исходные концентрации (моль/л): с А= 4; с В= 6. константа равновесия К = 1.
Решение. К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. Согласно уравнению реакции, на каждый моль веществ А и В образуется 2 моля вещества С. Поэтому если понижение концентрации веществ А и В обозначить через х моль, то увеличение концентрации вещества С составит 2 х моль.
|
|
|
Равновесные концентрации реагирующих веществ:
|
|
|


 К = = =;
К = = =;
|
 1 =;
1 =;
3 х 2+ 10 х – 24 = 0; х = 1,9.
Отсюда равновесные концентрации реагирующих веществ равны:
с А= 4 – 1,9 = 2,1 моль/л; с В= 6 – 1,9 = 4,1 моль/л; с С= 2. 1,9 = 3,8 моль/л.
Пример 4. Константа скорости реакции при 283 К равна 1,08. 10–4, а при 333 К равна 5,484. 10–2. Вычислить энергию активации и константу скорости реакции при 303 К.
Решение. Используя соотношение
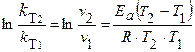 ,
,
получим:

Используя то же соотношение, получаем:

Индивидуальные задания
4.1. Реакция между газами протекает по уравнению А + 2В «3 C.
Константа скорости реакции k = 0,01. Начальные концентрации (моль/л): с А= 5,0; с В= 3,0. Найти концентрацию вещества А и скорость реакции в момент времени, когда концентрация вещества В стала равной 1,0 моль/л.
4.2. Начальные концентрации реагирующих веществ реакции
СО (г) + Н2О (г)«СО2 (г) + Н2(г)
были равны (моль/л): с СО= 0,8; с Н2О= 0,9; с СО2= 0,7; с Н2= 0,5. Вычислить концентрации всех участвующих в реакции веществ после того, как 75 % СО прореагировало.
4.3. Реакция идет по уравнению 4 HCl (г) + O2(г) «2 Н2О (г) + 2 Cl2 (г). Как изменится скорость реакции, если давление в системе увеличить в 3 раза?
4.4. При 393 К реакция заканчивается за 25 мин. За какое время эта реакция закончится при 443 К, если температурный коэффициент скорости равен 2,5?
4.5. Для реакции N2(г) + 3 H2(г) «2 NH3(г) константа равновесия равна 0,1. Равновесные концентрации (моль/л): с NH3= 9,0; с Н2= 3,0. Вычислить исходную и равновесную концентрации N2.
4.6. Для реакции Cl2(г) + CO (г) «COCl2(г) равновесные концентрации реагирующих веществ были (моль/л): с СО= 3,6; с Cl2= 5,0; с СОCl2= 6,4. Определить исходные концентрации хлора и оксида углерода.
|
|
|
4.7. Реакция в газовой фазе протекает по уравнению 2 А «В. Исходная концентрация вещества А равна 0,5 моль/л. Константа равновесия реакции равна 0,5. Найти равновесные концентрации веществ.
4.8. Для обратимой реакции СО (г) + Н2О (г) «СО2(г) + Н2(г) константа равновесия при некоторой температуре равна 1. Равновесные концентрации веществ были (моль/л): с Н2О= 0,6; с СО2= 0,8; с Н2= 0,8. Вычислить исходную концентрацию СО.
4.9. Найти значение константы скорости реакции А + В = АВ, протекающей в газовой фазе, если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 5. 10–5 моль/(л. с).
4.10. Во сколько раз изменится скорость реакции 2 А + В = А2В, протекающей в газовой фазе, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
4.11. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
4.12. В каком направлении сместятся равновесия
2 СO (г) + О2 (г)«2 СO2 (г); DH° = – 566 кДж;
N2(г) + О2 (г)«2 NO (г); DH° = 180 кДж
а) при понижении температуры; б) при повышении давления?
4.13. Во сколько раз увеличится скорость реакции, протекающей при 298 К, если ее энергию активации уменьшить на 4 кДж/моль?
4.14. Чему равна энергия активации реакции, если при повышении температуры от 290 до 200 К скорость ее увеличится в 2 раза?
4.15. Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К?
4.16. Энергия активации реакции О3 (г) + NO (г) = O2(г) + NO2 (г) равна 10 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры с 273 К до 283 К?
4.17. Как изменится скорость реакции О2 (г) + 2 NO (г) = 2 NO2 (г), если:
а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза; с) повысить концентрацию NO в 3 раза?
4.18. Как повлияет на равновесие следующих реакций
2 Н2(г) + О2 (г)«2 Н2O (г); DH° = – 483,6 кДж;
СаСO3(к)«СаO (к)+ СO2 (г); DH° = 179 кДж
а) повышение давления; б) повышение температуры?
4.19. Константа скорости реакции при температуре 600 К равна 7,5, а при 650 К равна 4,5. 102. Вычислить энергию активации и константу скорости реакции при 700 К.
4.20. Разложение N2О протекает по уравнению: 2 N2О (г) = 2 N2(г) + 2 О2(г). Константа скорости данной реакции k = 5. 10–4. Начальная концентрация N2О равна 6,0 моль/л. Определить скорость реакции в начальный момент и в тот момент, когда разложится 50 % N2О.
|
|
|
4.21. Реакция, протекающая в газовой фазе, выражается уравнением А + 2 В = С. Начальные концентрации составляют (моль/л): с А= 0,03; с В= 0,05. Константа скорости реакции k = 0,4. Найти начальную скорость реакции и скорость реакции в момент времени, когда с А уменьшилась на 0,01 моль/л.
4.22. В системе CO (г) + Cl2(г)= COCl2(г) концентрацию оксида углерода (II) увеличили с 0,3 до 1,2 моль/л, а концентрацию хлора – с 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
4.23. Равновесие в системе 2 NO2(г) «2 NO (г) + О2(г) установилось при следующих концентрациях (моль/л): с NO2= 0,006; с NО= 0,024. Вычислить константу равновесия реакции и исходную концентрацию NO2.
4.24. Константа равновесия реакции FeO (к) + CO (г) «Fe (к) + CO2 (г) равна 0,5. Найти равновесные концентрации CO и CO2, если начальные концентрации составляли (моль/л): с СO= 0,05; с СO2= 0,01.
4.25. Через некоторое время после начала реакции, протекающей в газовой фазе: 3 А + В = 2 С + D концентрации веществ составляли (моль/л): с А= 0,03; с B= 0.01; с C= 0,008. Рассчитать исходные концентрации веществ А и В.
4.26. Реакция протекает по уравнению N2(г) + 3 H2(г) «2 NH3(г). Как изменится скорость реакции, если: а) увеличить концентрацию N2в 3 раза, а концентрацию H2– в 5 раз; б) уменьшить объем системы в 2 раза; в) уменьшить давление в системе в 2 раза?
4.27. Исходные концентрации реагирующих веществ в реакции:
2 СО (г) + О2 (г)«2 СО2 (г)
были равны (моль/л): с СО= 0,5; с О2= 0,4. Константа скорости данной реакции k = 0,3. Вычислить скорость реакции в начальный момент времени и в тот момент, когда концентрация О2уменьшилась на 0,2 моль/л.
4.28. Равновесие в системе 2 Cl2 (г) + 2 H2O (г) «4 HCl (г) + O2 (г) установилось при следующих концентрациях (моль/л): с Cl2= 0,8; с Н2О= 2,2; с НCl= 0,4; с О2= 1,6. Вычислить константу равновесия и исходные концентрации Cl2и H2O.
4.29. При состоянии равновесия в системе:
N2(г)+ 3 H2(г) «2 NH3 (г); D H ° = – 92,4 кДж
концентрации веществ равны (моль/л): с NH3= 4,0; с Н2= 9,0; с N2= 3,0.
|
|
|
Определить: а) исходные концентрации N2и H2; б) в каком направлении сместится равновесие с ростом температуры; в) в каком направлении сместится равновесие, если уменьшить объем реакционного сосуда?
4.30. При 150 °С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитать, через какое время закончится эта реакция, если проводить ее: а) при 200 °С; б) при 80 °С.
Основы теории растворов
Общие представления о растворах. Способы выражения концентрации растворов. Физические и химические процессы при растворении. Сольватация, теплота растворения, физико-химическая теория растворов.
Растворы неэлектролитов. Растворение твердых веществ, жидкостей и газов в жидкостях. Законы Генри и Дальтона. Закон распределения. Закон Рауля.
Растворы электролитов. Теория электролитической диссоциации С.Аррениуса. Сильные и слабые электролиты. Степень диссоциации, константа диссоциации. Закон разведения Оствальда. Ступенчатая диссоциация. Состояние сильных электролитов в растворе. Понятие об активонсти ионов в растворе.
Электролитическая диссоциация воды, ионное произведение воды, водородный показатель. Понятие об индикаторах. Гидролиз солей.
Пример 1. В какой массе воды надо растворить 44,8 л HCl (объем измерен при н. у.), чтобы получить 26 %-й раствор HCl?
Решение. Согласно закону Авогадро, 44,8 л газа при н. у. соответствуют 2 моль HCl (молярная масса 36,5 г/моль), то есть m НCl= 2. 36,5 = 73 г. Массу воды в 26 %-м растворе, соответстующую данной массе растворенного вещества, находим из пропорции:
26 г HCl соответствует 74 г H2O,
73 г HCl ¾ x г H2O,
x = 73. 74 / 26 = 207,8 г H2O.
Пример 2. Какую массу воды надо прибавить к 3 моль К2SO4. 7H2O, чтобы получить 9 %-й раствор К2SO4?
Решение. Молярная масса К2SO4. 7H2O равна 300 г/моль, молярная масса К2SO4равна 174 г/моль, молярная масса H2O равна 18 г/моль. Массу сульфата калия,содержащегося в 3 моль кристаллогидрата, найдем из пропорции:
в 300 г К2SO4. 7H2O (1 моль) содержится 174 г К2SO4,
в 900 г К2SO4. 7H2O (3 моль) ¾ x г К2SO4,
x = 900. 174 / 300 = 522 г К2SO4.
Масса воды, содержащейся в 3 моль кристаллогидрата:
900 – 522 = 378 г H2O.
Массу воды в 9 %-м растворе, соответстующую 522 г К2SO4, находим из пропорции:
9 г К2SO4 соответствует 91 г H2O,
522 г К2SO4 ¾ x г H2O,
x = 9. 522 / 9 = 5278 г H2O.
С учетом уже имеющейся в составе кристаллогидрата воды, к 3 моль К2SO4. 7H2O необходимо прибавить:
5278 – 378 = 4900 г H2O.
Пример 3. Какой объем 0,3 М раствора Na3(PO4)2можно приготовить из 250 мл 1,5 н. раствора?
Решение. Молярная масса Na3(PO4)2равна 259 г/моль (соответственно, масса 0,3 моль составит 77,7 г), молярная масса эквивалента (эквивалентная масса) Na3(PO4)2равна 86,3 г/моль (соответственно, масса 1,5 экв. составит 129,5 г). Массу ортофосфата натрия в 1,5 н. растворе находим из пропорции:
|
|
|
в 1000 мл 1,5 н. раствора содержится 129,5 г Na3(PO4)2,
в 250 мл раствора ¾ x г Na3(PO4)2,
x = 129,5. 250 / 1000 = 32,4 г Na3(PO4)2.
Объем 0,3 М раствора, содержащего то же количество растворенного вещества, находим из пропорции:
в 1000 мл 0,3 М раствора содержится 77,7 г Na3(PO4)2,
в х мл раствора ¾ 32,4 г Na3(PO4)2,
x = 32,4. 1000 / 77,7 = 417 мл 0,3 М раствора.
Пример 4. Плотность 12 %-го раствора Na2SO3равна 1,08 г/мл. Вычислить моляльность, молярность и эквивалентную концентрацию (нормальность) этого раствора.
Решение. Молярная масса Na2SO3равна 126 г/моль, молярная масса эквивалента (эквивалентная масса) Na2SO3равна 63 г/моль.
Для вычисления моляльности найдем массу сульфита натрия, приходящуюся на 1000 г воды в 12 %-м растворе:
12 г Na2SO3 соответствует 88 г H2O,
x г Na2SO3 ¾ 1000 г H2O,
x = 12. 1000 / 88 = 136,4 г Na2SO3.
отсюда моляльность раствора: m = 136,4/126 = 1,08 моль на 1000 г H2O.
Для расчета молярности и нормальности раствора найдем массу сульфита натрия, содержащуюся в 1 л (т.е. в 1000. 1,08 = 1080 г) 12 %-го раствора:
в 100 г раствора содержится 12 г Na2SO3,
в 1080 г раствора ¾ х г Na2SO3,
x = 12. 1080 / 100 = 129,6 г Na2SO3.
Следовательно, СМ= 129,6/126 = 1,03 моль/л и Сн= 129,6/63 = 2,06 н.
Индивидуальные задания
5.1. Из 600 г 45 %-го раствора HNO3выпариванием удалили 100 г воды. Чему равна процентная концентрация оставшегося раствора?
5.2. Определить процентную концентрацию раствора, полученного смешением 250 г 30 %-го и 350 г 70 %-го растворов.
5.3. Какой объем воды надо прибавить к 200 мл 25 %-го раствора HCl (r = = 1,12 г/мл), чтобы получить 10 %-й раствор?
5.4. Найти процентную концентрацию раствора NaOH, в 1 л которого содержится 400 г NaOH (r = 1,31 г/мл).
5.5. Плотность 30 %-го раствора Н2SO4равна 1,22 г/мл. Сколько моль Н2SO4находится в 3,5 л раствора?
5.6. Для приготовления 10 %-го раствора Na2SO4взято 250 г Na2SO4 . 10H2O. Найти массу полученного раствора.
5.7. Определить процентную концентрацию CаCl2в растворе, полученном при растворении 80 г CаCl2 . 5Н2О в 650 г воды.
5.8. Найти молярность 30 %-го раствора КОН, плотность которого 1,29 г/мл.
5.9. Плотность 25 %-го раствора НNO3равна 1,14 г/мл. Рассчитать молярность и моляльность этого раствора.
5.10. Вычислить процентную концентрацию 10,5 н. раствора КOH (r = 1,42 г/мл).
5.11. В 1,5 кг воды растворено 700 г NaОН (r = 1,35 г/мл). Найти процентную концентрацию и молярность раствора.
5.12. В какой массе воды нужно растворить 40 г К2SO4. 7H2O, чтобы получить 15 %-й раствор К2SO4?
5.13. Какой объем 5 М раствора К2SO4надо взять для приготовления 2 л 0,5 н. раствора?
5.14. К 150 мл 60 %-ной HNO3(r = 1,37 г/мл) прибавили 350 мл воды. Получился раствор плотностью 1,13 г/мл. Вычислить его процентную и эквивалентную концентрации.
5.15. В 2 кг воды растворено 500 г К2SO3(r = 1,18 г/мл). Найти эквивалентную концентрацию и моляльность раствора.
5.16. Рассчитать нормальность концентрированной серной кислоты, содержащей 65,5 % H2SO4(r = 1,56 г/мл).
5.17. Сколько граммов MgSO3потребуется для приготовления 4 л 15 %-го раствора (r = 1,34 г/мл)?
5.18. Какой объем 4,5 н. раствора CuCl2надо взять для приготовления 2 л 1,7 М раствора?
5.19. Сколько граммов воды нужно добавить к 250 г 40 %-го раствора MgCl2, чтобы получить 15 %-й раствор соли?
5.20. В какой массе воды надо растворить 33,6 л H2S (объем измерен при н. у.), чтобы получить 14 %-й раствор H2S?
5.21. Какой объем 7,2 М раствора NaCl нужно взять для приготовления 50 г 0,9 %-го раствора NaCl?
5.22. Найти массу КОН, необходимую для приготовления 250 мл 1,4 М раствора.
5.23. До какого объема нужно разбавить 300 мл 35 %-го раствора СaCl2 (r = 1,37 г/мл), чтобы получить 0,2 н. раствор?
5.24. Какой объем воды надо прибавить к 2,5 моль MgSO4. 9H2O, чтобы получить 18 %-й раствор MgSO4?
5.25. Сколько граммов воды надо взять для приготовления 1,5 m раствора NaОН, если имеется 25 г NaОН?
5.26. Какой объем воды надо добавить к 420 г Na2SO4 . 7H2O, чтобы получить 28 %-й раствор Na2SO4?
5.27. К 340 мл 46 %-й HNO3(r = 1,28 г/мл) прибавили 1,7 л воды. Какова процентная концентрация полученного раствора?
5.28. Какой объем 0,2 М раствора H3PO4можно приготовить из 140 мл 3,4 н. раствора?
5.29. Какую массу H2O надо добавить к 850 г 37 %-го раствора NaCl, чтобы получить 14 %-й раствор?
5.30. Плотность 30 %-го раствора H3PO4равна 1,18 г/мл. Вычислить моляльность, молярность и эквивалентную концентрацию этого раствора.
Физико-химический анализ
Сущность физико-химического анализа. Правило фаз Гиббса. Диаграмма состояния унарной системы.
Термографический анализ. Принципы построения диаграмм плавкости бинарных систем.
Эвтектическая диаграмма. Диаграмма плавкости системы с неограниченными твердыми растворами. Правило «рычага». Диаграммы плавкости системы с ограниченными твердыми растворами. Дистектическая диаграмма плавкости.
Основы электрохимии.
|
|
|


