 |
Физико-химические показателя этилсиликатов
|
|
|
|
Физико-химические показателя этилсиликатов
| Показатель | ЭТС-32 (ТУ6-02-895 — 86) | ЭТС-40 (ГОСТ 26371 — 84) | NT-40 | Silester-05 | Dinasil-40 | ||
| Высший сорт | 1-й сорт | ||||||
| Вид материала | Прозрачная жидкость | От бесцветной жидкости до жидкости слегка желтоватого цвета | |||||
| Плотность, кг/м3 | Свыше 1000 | 1050— 1070 | 1040 — 1070 | 1050- 1070 | ≈ 1070 | 1050— 1070 | |
| Кинематическая вязкость, М2/С | 1, 6 | 3, 5 - 6 | 3, 5 - 6 | 3 — 5 | ≈ 5 | ||
| Содержание компонента, %: |
| ||||||
| SiO2 | 30 — 34 | 40 — 42 | 38 — 42 | 38 - 42 | ≈ 41 | 40 — 42 | |
| НС1, не более | 0, 1 | 0, 05 | 0, 1 | 0, 1 | - | — | |
| тетраэто-ксисилан | 50 — 70 | 10 — 15 | 10 — 15 | — | — | — | |
| этоксильные группы | — | 70 — 73 | 70 — 75 | — | — | — | |
| этиловый спирт | 1, 5 | 1, 5 | — | ≈ 1 |
| ||
6. 3. 1. Термодинамическая устойчивость водных
растворов этилсиликата.
Этилсиликат представляет собой прозрачную, слегка окрашенную в желтый или бурый цвет жидкость с характерным запахом. По химическому составу он относится к эфирам орто-кремниевой кислоты Si (OC2 H5)4 с температурой кипения 438, 5° К при атмосферном давлении.
Впервые этилсиликат был получен в 1845 г. в результате реакции между ортокремниевой кислотой и этиловым спиртом (реакция этерификации).
В настоящее время этилсиликат получают из четыреххлористого кремния:
SiCI4 + 4С2Н5ОН ↔ Si(OC2H5)4 + 4НСl.
Эта реакция может быть представлена как сумма реакций этерификации и осаждения гидрата окиси кремния соляной кислотой:
SiCl4 + 4H2O ↔ Si(ОН)4 + 4HCl
Si(ОН)4 + 4С2Н5ОН ↔ Si (OC2H5)4 + 4H2O
------------------------------------------------------------------------------------
SiCl4 + 4С2Н5ОН ↔ Si(OC2H5)4+ 4НС1
Из первых двух реакций, протекающих последовательно, вторая более медленная. Они требуют повышенных температур и концентрации реагирующих веществ. Скорость суммарного процесса ограничивается скоростью наиболее медленной реакции, в данном случае — скоростью реакции этерификации. Рассмотрим эту реакцию подробнее:
|
|
|
4С2Н5ОН + H2SiO4 ↔ Si(OC2H5)4 + 4H2O
Реакция этерификации — реакция второго порядка. Увеличение выхода эфира может быть достигнуто за счет повышения концентрации одного из исходных компонентов реакции (обычно спирта). Очень сильное влияние на скорость реакции этерификации оказывает ангидрид трифторуксусной кислоты, который способствует удалению воды из зоны реакции. В соответствии с принципом Ле-Шателье удаление образующейся воды смещает равновесие реакции вправо. Аналогично, первая реакция протекает более полно при удалении хлористого водорода при температуре 393— 400° К. Однако полностью удалить его не удается, в результате до 0, 3% НС1 остается в этилсиликате.
В конечной реакции образования этилсиликата вода не участвует, хотя ее присутствие коренным образом изменяет течение реакции. Кроме того, реакция этерификации обратима: эфир взаимодействует с водой, образуя кислоту и спирт (реакция омыления):
Si(OC2H5)4 + 0. 5H2O ↔ ½ Si2O(OC2H5)6+ 2 C2H5OH
Si(OC2H5)4 + 3/4H2O ↔ 1/4Si4O3(OC2H5)10+ 2/3C2H5OH
Si(OC2H5)4 + 15/6H2O ↔ 1/6Si6O5(OC2H5)14+ 10/3C2H5OH
Таким образом, этилсиликат состоит из ряда полисилоксанов силиконов).
Схему строения молекул полисилоксанов можно [редставить следующим образом:
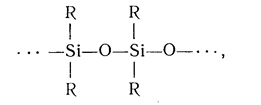
•де R — углеводородный радикал, в данном случае R — этокси-
группа (—OC2H5).
Различают моноэфир Si(OC2H5) (тетраэтоксисилан)

диэфир Si2O(OC2H5)6 (гексаэтоксидисилоксан)

триэфир Si3O2(OC2H5)8 (октаэтокситрисилоксан)

Полисилоксаны, которые могут входить в состав этилсиликата, приведены в табл. 6. 9.
Для получения этилсиликата из четыреххлористого кремния можно использовать спирт с разным содержанием воды. В соответствии с этим получаются эфиры (полисилоксаны) различной сложности.
|
|
|
При использовании обезвоженного спирта этилсиликат содержит 70—80% моноэфира и 20—30% полиэфиров (полисилоксанов). Такой этилсиликат называют техническим. Он содержит 28—30% SiO2 (в пересчете на окись кремния).
При использовании для получения этилсиликата спирта-ректификата, содержащего 4% воды, увеличивается выход полисилоксанов. Этилсиликат содержит 30—37% SiO2.
При использовании гидролизного спирта, содержащего 7—9% воды, еще более увеличивается выход полисилоксанов. Этилсиликат содержит до 38—43% SiO2.
Сам по себе этилсиликат является плохим связующим. Для образования прочной массы, скрепляющей зерна наполнителя, необходимо перевести этилсиликат в коллоидное состояние с последующим его превращением в золь.
Перевод этилсиликата в золь осуществляется гидролизом, при котором этоксигруппы (—ОС2Н5) частично или полностью заменяются гидроксильными группами (—ОН).
Например, гидролиз моноэфира можно представить следующей схемой:

По мере замещения этоксигрупп гидроксильными состав продуктов гидролиза приближается к составу ортокремневой кислоты

Структурная схема ортокремневой кислоты в свежеприготовленном гидролизованном растворе имеет следующий вид:

Таблица 17
Характеристика полисилоксанов
| поликсилоксаны | Молекулярная масса | Условное содержание SiO2 в % | Температура кипения в оС |
| Моноэфир (тетраэтоксисилан) | 28, 8 | 439, 7 | |
| Диэфир (гексаэтоксидисилоксан) | 35, 1 | 424-434 (40)* | |
| Триэфир (октаэтокситрисилоксан) | 37, 8 | - | |
| Тетраэфир (декаэтокситетрасилоксан) | 39, 3 | 481-485 (0, 4)* | |
| Пентаэфир (додекаэтоксипентасилоксан) | 40, 3 | ||
| Гексаэфир (тетрадекаэтоксигексасилоксан) | 42, 0 | 515-520 (0, 53)* |
· - давление в н/м2
В присутствии электролита (например, кислоты) молекулы ортокремневой кислоты соединяются поперечными химическими связями и образуют трехмерную сетку (процесс протекает с выделением воды).
В результате получается раствор с коагуляционной структурой, обладающей пластично-вязкими свойствами. По мере удаления влаги образуются и получают развитие структуры, обладающие упруго-хрупкими свойствами. При постепенном удалении воды раствор переходит в гель. В геле кремневой кислоты после высушивания и прокаливания можно обнаружить кристаллическую структуру.
|
|
|

Следовательно, полный процесс гидролиза моноэфира с образованием золя SiO2 описывается реакциями:

Таким образом, при гидролизе 1 моля моноэфира 2 молями воды получается золь кремневой кислоты, не содержащий свободной воды. Количество воды, рассчитанное по этим реакциям, для гидролиза является теоретически необходимым количеством для гидролиза этилсиликатаили стехиометрической нормой воды. При гидролизе моноэфира меньшим количеством воды, чем 2 моля на. 1 моль эфира, образуются продукты неполного гидролиза:
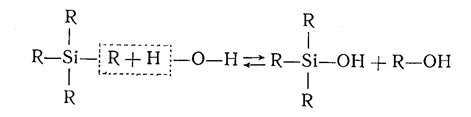
При гидролизе большим количеством воды образуются различные кремневые кислоты:

Кремневые кислоты малорастворимы в воде. Их устойчивость зависит от рН среды. При рН = 5—6 кремневые кислоты распадаются с образованием геля, переходящего в золь.
Одновременно с процессом гидролиза эфиров в растворе протекают процессы конденсации и полимеризации. Например, молекулы гидролизованного моноэфира частично укрупняются и выделяется вода:

Получившийся диэфир (гексаэтоксидисилоксан) гидролизуется выделившейся при конденсации водой, в результате образуется пентаэтоксидигидросилоксан:

Это соединение может конденсироваться дальше с образованием тетраэфира

Тетраэфир вновь омыляется водой и полимеризуется, образуя полисилоксаны
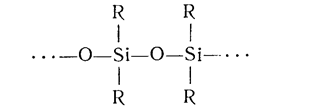
Реакция полимеризации может протекать через концевые этоксильные группы с образованием циклических полисилоксанов:

По мнению И. Н. Кривенко, гидролиз этилсиликата при комнатной температуре протекает преимущественно с образованием сетчатых структур, которые обладают лучшими связывающими свойствами. Искусственный подогрев раствора способствует образованию линейных структур, имеющих меньшую прочность.
Реакция гидролиза этилсиликата сопровождается выделением большого количества тепла и повышением температуры раствора. Регулированием температуры реакции гидролиза, например изменением количества вводимой воды, можно управлять структурой получающегося связующего — полисилоксана.
|
|
|
Конденсация полисилоксанов может протекать как по концевым связям, так и по внутренним, например:

При дальнейшем гидролизе этого соединения с последующей полимеризацией может образоваться сетчатая структура.
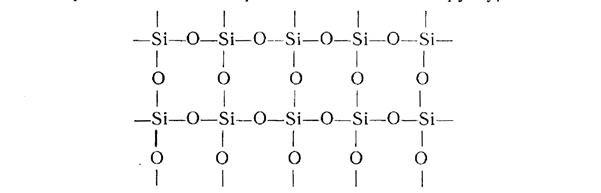
Катализаторами гидролиза и полимеризации полисилоксанов могут быть соляная и серная кислоты и их соли, щелочи, аммониевые основания (R4N) ОН и другие соли, изменяющие рН раствора.
На практике в качестве катализатора гидролиза широко применяют гидрат окиси аммония NH4OH. Его действие заключается в омылении этоксильных групп и перевода их в гель:

В результате полного гидролиза полисилоксанов образуется гель кремневой кислоты.
Из реакций гидролиза и полимеризации полисилоксанов следует, что сложные эфиры, образующиеся в процессе получения этилсиликата с применением гидролизного спирта и спирта-ректификата, являются продуктами полимеризации моноэфира водой. Таким образом, количество воды, необходимое для гидролиза, рассчитывают по содержанию этилсиликата мономера.
|
|
|


