 |
Направленное перемещение рибосом
|
|
|
|
Направленное перемещение рибосом
Направленное перемещение рибосом включает три этапа.
1. Распознавание сигнальной последовательности
2. Прекращение удлинения
3. Перемещение к мембране ЭР
SRP комплекс (SRP + рибосома) направляется к мембране ЭР и связывается с SRP-R (SRα и SRβ ). Это связывание вызывает активацию GTPaзы SRP-54 и GTPaз двух рецепторных субъединиц, что влечет за собой освобождение SRP от рибосомы и прикрепление рибосомы к транслокону — белковому комплексу в мембране ЭР.
Перенос формирующейся цепи через мембрану происходит через расширенный канал. Механизм образования канала изучен еще не до конца. При использовании уникальных типов флюоресцентных красителей, прикрепленных к искусственной сигнальной последовательности, было показано, что водный канал формируется белками транслокона и рибосомой. Почти все белки, предназначенные для секреции или для встраивания в мембрану, транслируются и переносятся рибосомами, прикрепленными к мембране ЭР. Модель утилизации GTP молекулой SRP-54 описана ниже.
Сразу после переноса трансляционного комплекса к транслокону и освобождения сигнального пептида от SRP-54 и SRP-9\14 трансляция возобновляется. Сигнальный пептид остается связанным с липидным бислоем, возможно он погружен в гидрофобные участки мембраны. Полипептид удлиняется, но остается прикрепленным к внутренней поверхности мембраны с помощью сигнального пептида. При достижении терминирующего трансляционного кодона рибосома отделяется от мРНК, и последние участки белка переносятся через мембрану ЭР. Завершающийся перенос нового пептида активирует связанную с внутренней поверхностью мембраны ЭР протеазу, которая отщепляет сигнальный пептид от вновь синтезированного белка. Сигнальный пептид высвобождается из мембраны и расщепляется другими протеазами, находящимися в полости.
|
|
|
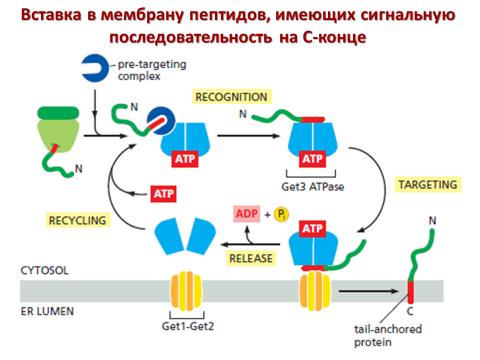
Механизмы переноса секреторных белков
и монотопных мембранных белков
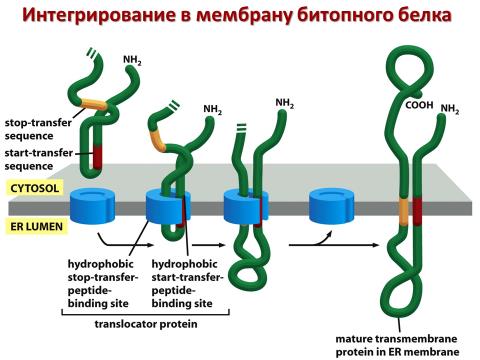
Перенос полипептидов, входящих в состав различных мембранных белков, происходит по-разному. Напомним, что существует два основных типа интегральных мембранных белков: белки, содержащие один трансмембранный домен (монотопные) и белки, содержащие несколько петель, пересекающих мембранный бислой (политопные).
Сначала обсудим монотопные мембранные белки. Вспомним, что функция и структура любого белка закодирована в его гене. Точно так же существует N-концевая сигнальная последовательность (как описано выше), которая переносит секреторные белки через мембрану ЭР, а также внутренняя сигнальная последовательность, узнаваемая SRP, которая прикрепляется к ней и вызывает дестабилизацию рибосомно-транслоконного комплекса. Это в свою очередь предотвращает перенос пептида, но не предотвращает дальнейшей трансляции. Таким образом, последовательность окончания переноса закрепляет удлиняющийся белок в мембране и становится трансмембранным доменом этого монотопного мембранного белка.
Существуют две разновидности этого процесса. Описанный выше простой вариант подходит для монотипных белков, ориентированных N-концом в полость ЭР и С-концом (СООН) в цитозоль. Многие мембранные белки имеют противоположную ориентацию, то есть их сигнальная последовательность (также называемая последовательностью начала переноса) располагается достаточно далеко от N-конца белка. Когда эта последовательность выходит из рибосомального канала, SRP узнает ее и переносит рибосомальный комплекс к мембране ЭР. Внутренний сигнал начала переноса действует точно так же, как и сигнальный пептид, и связывается с компонентами транслокона, которые быстро переносят его внутрь транслокационного канала. В отличие от N-концевой сигнальной последовательности, эта последовательность не распознается сигнальной пептидазой и не отщепляется. По-видимому, мембранный канал способен увеличиваться в размере для того, чтобы вместить и растущую цепь, и прикрепленный сигнальный пептид.
|
|
|
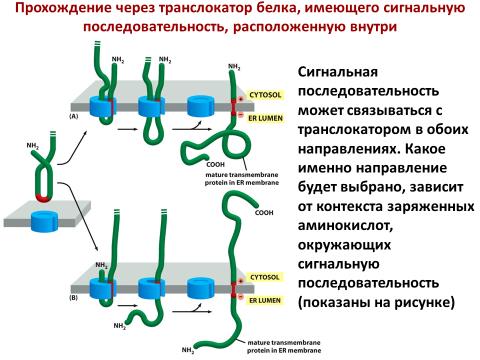
Исследование того, какие типы аминокислот расположены по обе стороны от гидрофобной трансмембранной последовательности, позволяет понять, каким образом происходит связывание М-домена белка SRP-54. Существуют группы положительно заряженных аминокислот с обеих сторон гидрофобной сигнальной последовательности, которые способствуют захвату этого белка в бислой. Ключом к пониманию того, как ориентирован сигнальный пептид, служит количество положительно заряженных остатков с каждой стороны. Чем больше заряд, тем более вероятно, что белок будет ориентирован на цитозольную сторону мембраны, так как показано для I типа мембранных белков на рис. 3-14.

Рис. 3-14. Этапы встраивания в мембрану сигнального якорного белка. Гидрофобное ядро сигнально-якорной последовательности (А) взаимодействует с мембраной эндоплазматического ретикулума (ЭР), и (Б) внедряется в мембрану, формируя петлю либо с N-концом (I тип), либо с С-концом (II тип) белка. Затем (В) соответствующий конец белка переносится в полость ЭР. (Сфера — группа заряженных аминокислотных остатков, которые часто соседствуют с сигнально-якорной последовательностью с цитоплазматической стороны от мембраносвязанного домена). (Воспроизведено с изменениями с разрешения авторов из: High S et al. Mechanisms that determine the transmembrane disposition of proteins. Curr Opin Cell Biol 1995; 7: 583. )


|
|
|


