 |
Механизмы формирования политопных белков
|
|
|
|
Многие мембранные белки несколько раз прошивают липидный бислой. Эти политоппые белки формируются в том случае, если в определенных участках полипептидной цепи находятся последовательности начала переноса и окончания переноса. Когда последовательность начала переноса выходит из рибосомального канала, с ней взаимодействует SRP, а затем этот комплекс связывается с SRP-R для прикрепления к транслокону. Как только появляется последовательность окончания переноса, перенос через мембрану прекращается, но трансляция продолжается.
Когда SRP узнает вторую последовательность начала переноса, она связывается и с помощью SRP-R переносится к ЭР для переноса через мембрану. Таким образом, политопный белок, содержащий серию последовательностей начала и окончания переноса, прошивает бислой. Будет ли данная гидрофобная последовательность сигналом начала или сигналом окончания, зависит от количества и распределения положительно заряженных аминокислот, соседствующих с ней. Большая группа заряженных аминокислот обычно остается на цитозольной стороне ЭР в направлении NH2.
В полости ЭПС синтезированные водорастворимые белки подвергаются фолдингу и гликозилированию путём присоединения к белкам однотипных олигосахаридных цепочек. В результате фолдинга белки приобретают специфическую конформацию, и в составе транспортных пузырьков, отделяющихся от мембраны ЭПС, транспортируются в комплекс Гольджи, где подвергаются дальнейшим модификациям и сортировке.
Наряду с секреторными белками на гранулярной ЭПС синтезируется большая часть полуинтегральных и интегральных белков. В ЭПС происходит также синтез мембраны липидов и осуществляется «сборка» компонентов мембраны. При этом увеличения общей площади мембранной ЭПС не происходит. Это связано с тем, что некоторые фрагменты мембраны ЭПС постоянно утрачиваются в составе отделяющихся от нее транспортных пузырьков, которые переносят их в аппарат Гольджи и далее в другие мембранные структуры клетки:
|
|
|
- плазмалемму;
- лизосомы.
Кроме того, ЭПС, как считают, участвуют в образовании пероксисом. Таким образом, грЭПС служит «фабрикой» мембран для плазмалеммы, аппарата Гольджи, лизосом и других мембранных структур клетки. ЭПС обеспечивает также сегрегацию (разделение) белков, предназначенных на экспорт, и лизосомных гидролаз от литозольных белков.


Связанный с ER-мембраной шаперон calnexin связывается с не полностью свернутыми белками, содержащими ОДНУ концевую глюкозу в N-связанном олигосахариде, удерживая белок в ЭПС. Удаление концевой глюкозы глюкозидазой высвобождает белок от кальнексина. Глюкозил-трансфераза – ключевой фермент, определяющий – свернут белок или нет. Если белок всё еще не полностью свернут, она навешивает еще одну глюкозу из UDP-глюкозы на N-linked oligosaccharide (N-связанный олигосахарид), возобновляя аффинность (сродство, стремление с ним связаться) белка к кальнексину. Цикл повторяется до тех пор, пока белок не будет свернут полностью. Кальретикулин функционирует сходным образом, кроме того что он – растворимый резидентный белок ER. Другой шаперон ЭПС - ERp57 - работает вместе с кальнексином и кальретикулином, узнавая свободные сульфгидрильные группы, которые являются признаком не полностью сформированных дисульфидных мостиков (практически все сульфгидрильные группы в ER образуют сульфидные мостики).


Агранулярная (гладкая) эндоплазматическая сеть представляет собой замкнутую сеть трубочек, канальцев, цистерн и везикулярных образований размером 50 —100 нм и образуется, по-видимому, из гранулярной ЭПС.
|
|
|
На цитоплазматической поверхности гладкой ЭПС синтезируются жирные кислоты, холестерол и большая часть липидов клетки, в том числе почти все липиды, необходимые для построения клеточных мембран. Поэтому гладкую ЭПС нередко называют «фабрикой липидов». В клетках печени (гепатоцитах) с мембранами гладкого эндоплазматического ретикулума связан фермент, обеспечивающий образование глюкозы из глюкозо-6-фосфата. Эта реакция имеет большое значение в поддержании уровня глюкозы в организме человека. Кроме того, гладкая эндоплазматическая сеть осуществляет детоксикацию (обезвреживание) ксенобиотиков, а также ядовитых веществ, образующихся в процессе метаболизма и подлежащих удалению из организма. Большую роль в процессах детоксикации играют ферменты семейства цитохрома Р450, катализирующие реакции гидроксилирования или микросомального окисления. В результате указанных реакций липофильные (нерастворимые) вещества становятся более гидрофильными (растворимыми), заключаются в другие реакции и затем выводятся из организма.
Помимо указанных основных функций, гладкая эндоплазматическая сеть выполняет ряд дополнительных. В ее мембранах локализуются Са2+ - насосы, активно закачивающие ионы Са2+ из цитозоля в полость саркоплазматической сети. Поэтому концентрация ионов Са2+ в полости гладкой эндоплазматической сети достигает 10-3 моль/л, т. е. почти в 10 000 раз выше, чем в цитозоле. Под действием химических сигналов ионы Са2+ переносятся из полости гладкой ЭПС через ионные каналы, встроенные в ее мембрану, в гиалоплазму, где связываются с определенными белками, влияющими на множество внутриклеточных процессов: активацию или инактивацию ферментов, экспрессию генов, освобождение антител из клеток иммунной системы и др.
В мышечных волокнах гладкая ЭПС имеет структурные и функциональные особенности и называется саркоплазматической сетью. При возбуждении плазмалеммы выход ионов Са2 из гладкой эндоплазматической сети в цитозоль стимулирует сокращение миофибрилл.
В организме человека эндоплазматическая сеть особенно хорошо развита в клетках, синтезирующих гормоны, в клетках печени (гепатоцитах) и некоторых клетках почек.
|
|
|
Комплекс Гольджи (КГ), или аппарат Гольджи , - пластинчатый комплекс, расположен вблизи ядра, между ЭПС и плазмалеммой. Его структурно-функциональная единица — диктиосома представляет собой стопку из 5—20 плоских одномембранных мешочков (цистерн), имеющих диаметр около 1 мкм, внутренние полости которых не сообщаются друг с другом. Количество таких мешочков в стопке обычно не превышает 5-10, а расстояние между ними составляет 20—25 нм.
В каждой диктиосоме различают три части, проксималъную (cis-полюс), обращенную к ЭПС, медиальную и дистальную (trans- полюс), обращенную к плазмалемме. К дистальной цистерне транс-полюса примыкают многочисленные трубочки и пузырьки, образующие транс-сеть аппарата Гольджи.

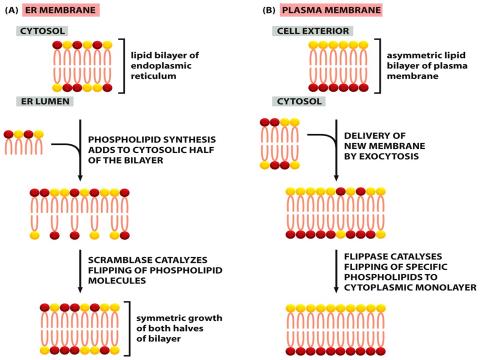
Плазматическая мембрана содержит другой тип транслокатора фосфолипидов, принадлежащих семейству насосов P-типа. Такие флиппазы специфически узнают те фосфолипиды, которые содержат свободные аминогруппы в своих головках (фосфатидилсерин и фосфатидилэтаноламин), и перебрасывают их из внешнего слоя (внеклеточного) на внутреннюю сторону мембраны (цитозольную), используя энергию гидролиза АТФ. Таким образом, плазматическая мембрана высоко асимметрична.
Плазматическая мембрана так же содержит и скрамблазу, но в отличие от постоянно активной скрамблазы ER, плазматическая мембрана регулируется и активируется лишь в некоторых случаях, таких как, например, апоптоз и активированные тромбоциты. При этом асимметрия плазматической мембраны нарушается. Экспозиция на внешнюю сторону клеточной мембраны апоптотических клеток служит сигналом для фагоцитирующих клеток для переваривания и деградации мертвых клеток.






Белки, синтезированные на шероховатой эндоплазматической сети в составе отпочковывающихся от нее мембранных пузырьков, покрытых клатрином, транспортируются к цис-полюсу аппарата Гольджи. В аппарате Гольджи осуществляется химическая модификация транспортируемых белков. Этот процесс происходит поэтапно по мере транспорта белков от цис- к транс-полюсу аппарата Гольджи, каждая цистерна которого содержит характерный для нее набор ферментов. Гликопротеины, несущие первоначально одинаковые олигосахаридные цепочки, в проксимальных цистернах подвергаются последовательной перестройке, специфической для белков каждого вида. В процессе гликозилирования одни олигосахаридные остатки удаляются, другие добавляются с образованием дополнительных ветвей олигосахаридов. В аппарате Гольджи некоторых специализированных клеток синтезируются полисахариды, которые, соединяясь с белками, образуют протеогликаны, составляющие основу вещества межклеточного матрикса. Таким образом, химическая перестройка белков в цистернах цис-полюса аппарата Гольджи осуществляется главным образом путем их гликозилирования, тогда как в транс-полюсе происходит в основном сульфатирование и фосфорилирование белков. Некоторые белки в комплексе Гольджи подвергаются протеолитическому расщеплению, в результате чего первоначально неактивные молекулы приобретают биологическую активность. Например, таким путем в клетках поджелудочной железы образуется инсулин.
|
|
|
В комплексе Гольджи протекают реакции синтеза мембранных гликолипидов. При этом углеводные компоненты в молекулах синтезированных мембранных гликолипидов, также как и у гликопротеинов, всегда оказываются обращенными в полость цистерн аппарата Гольджи. Этим объясняется топология углеводных остатков молекул мембранных гликолипидов и гликопротеинов при включении их в состав плазмалеммы, где они участвуют образовании гликокаликса.
В транс-сети осуществляется сортировка белков и упаковка их в мембранные пузырьки, покрытые клатрином. Белки, предназначенные для экспорта, заключаются в одни пузырьки, лизосомные белки — в другие, мембранные белки — в третьи. В специальные пузырьки упаковываются также белки, присущие ЭПС, например ферменты фолдинга, которые случайно оказались в комплексе Гольджи.
Сортировка белков осуществляется при помощи встроенных в мембрану транс-сети КГ особых белков-рецепторов, способных специфически взаимодействовать с определенными химическими группировками — маркерами молекул отбираемых белков. В результате участок мембраны, несущей рецепторы, связанные с маркерами отбираемых молекул, обособляется от КГ с образованием мембранного пузырька, покрытого клатрином, транспортирующего нужное вещество к месту назначения. Например, маркером лизосомальных ферментов служит присоединяющийся к ним в комплексе Гольджи олигосахарид, содержащий остаток маннозо-6-фосфата. Для белков ЭПС — ферментов фолдинга и др., которые случайно оказались в КГ, таким маркером служит последовательность из четырех аминокислот, по которой они узнаются и упаковываются в пузырьки, а затем возвращаются обратно в ЭПС. Этот процесс получил название рециклизации.
|
|
|
Секреция экспортных белков осуществляется посредством конститутивной и регулируемой секреции.
В случае конститутивной секреции, которая характерна для всех клеток, транспортные пузырьки непрерывно переносятся от аппарата Гольджи к плазмалемме. Таким путем, например, доставляются к поверхности клетки элементы гликокаликса. А также многие продукты, составляющие основу межклеточного вещества. Посредством конститутивной секреции осуществляется также транспорт мембранных белков плазмалеммы.
Регулируемая секреция свойственна лишь специализированным клеткам, секретирующим биологически активные вещества в ответ на действие сигналов, например гормонов.
Таким образом, основными функциями комплекса Гольджи являются химическая модификация, накопление, сортировка, упаковка в секреторные пузырьки и транспорт по назначению белков и липидов, синтезированных в эндоплазматическом ретикулуме. В комплексе Гольджи образуются лизосомы и синтезируются некоторые полисахариды.


|
|
|


