 |
5. Вакуумно-конденсаційні процеси
|
|
|
|
5. ВАКУУМНО-КОНДЕНСАЦІЙНІ ПРОЦЕСИ
НАНЕСЕННЯ ПОКРИТТІВ
5. 1Теоретичні відомості
Утворення вакуумних покриттів визначається послідовним проходженням складних фізико-хімічних процесів, а саме:
- випаровуванням чи розпиленням вихідного матеріалу покриття;
- спрямованим масоперенесенням у вигляді потоку атомів чи іонів матеріалу покриття на поверхню основи;
- співударом потоку з поверхнею і наступною адсорбцією чи десорбцією атомів чи іонів на ній;
- поверхневою дифузією атомів до місць найкращого утворення зародків покриття;
- міграцією та коалесценцією зародків і ростом острівців до зростання; зрощенням острівців у суцільну плівку; ростом суцільної плівки й утворенням покриття необхідної товщини.
Форма і товщина покриття визначаються формою та густиною потоку випарованих атомів.
У високому вакуумі швидкість випаровування атомів визначається співвідношенням Ленгмюра:
w= 4, 4  (5. 1)
(5. 1)
де р - тиск насиченої пари, Па; М - молекулярна маса речовини; Т -температура випаровування, К.
При випаровуванні сплавів тиск пари кожного компонента відрізняється від тиску над чистим металом і називається парціальним тиском даного компонента.
Для оцінки парціального тиску над рідинним сплавом можна застосовувати закон Рауля. Наприклад, для бінарного сплаву з компонентів А і В можна записати:
 =
= 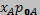 ;
;  =
=  ; (5. 2)
; (5. 2)
де РА, Рв - парціальні тиски пари компонентів рідкого сплаву; РОА, Ров - тиски пари чистих компонентів при температурі рідкого сплаву; ХА, Хв - мольні частки компонентів у сплаві: ХА + Хв = 1.
|
|
|
Якщо РОА ≈ Ров, тоді:
 (5. 3)
(5. 3)
і проходить узгоджене випаровування, тобто склад сплаву і склад пари практично постійний у процесі випаровування.
Для більшості реальних сплавів спостерігається відхилення від закону Рауля. Для оцінки їх поведінки вводять емпіричну величину, яку називають активністю:
 (5. 4)
(5. 4)
де р - тиск пари даного компонента над сплавом; Р0 - його тиск над чистою речовиною.
Активність пов'язана з мольною часткою через коефіцієнт активності f:

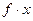 (5. 5)
(5. 5)
Залежно від типу реального сплаву, коефіцієнт активності може бути більше чи менше одиниці. З урахуванням f, парціальні тиски пари компонентів реального бінарного сплаву дорівнюють:
 =
=  ;
;  =
= 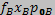 ; (5. 5)
; (5. 5)
Підставляючи значення РА і РB з (5. 5) в (5. 1), отримуємо вирази для швидкостей випаровування складових бінарного сплаву.
 =
= 
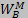 =
= 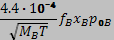 . (5. 6)
. (5. 6)
Відношення цих швидкостей дорівнює відношенню кількості атомів компонентів А і В в першій фазі на даний момент часу, тобто:
 =
=  (5. 7)
(5. 7)
Якщо припустити, що коефіцієнт активності не залежить від концентрації, можна виділити емпіричний параметр, який характеризує бінарну систему:
K=  (5. 8)
(5. 8)
Сплави з параметром К = 1 випаровуються узгоджено. У сплавах з параметром К ≠ 1 спочатку випаровується компонент з високим тиском пари, і у міру збільшення його кількості - компонент із низьким тиском пари. Відмінність виявляється тим сильніше, чим більше параметр К є відмінним від одиниці, і чим вище вихідна молярна концентрація компонента з високою пружністю пари. Це приводить до виникнення градієнта концентрації по товщині покриття. Прилеглі до поверхні основи шари містять максимальну кількість легколетучого компонента.
|
|
|
Найбільш досконалим способом нагріву та випаровування матеріалу є електронно-променеве нагрівання. При зіткненні з поверхнею матеріалу кінетична енергія електрона витрачається на збудження рентгенівського випромінювання, утворення вторинних електронів і нагрівання.
Основна частина кінетичної енергії перетворюється на теплову в тонкому поверхневому шарі. При прискорюючій напрузі 15... 20 кВ глибина проникнення електрона в металеві матеріали становить 1... 2 мкм. Основне гальмування та виділення енергії відбувається в кінці проходження, тобто температура сягає максимуму на певній відстані від поверхні. Таким чином, при нагріванні електронним променем джерело теплоти знаходиться у самому тілі, в тонкому поверхневому шарі. Тиск електронного променя і конвекція, яка викликана градієнтом температури, забезпечують інтенсивне перемішування рідкої ванни. Тому приблизно можна вважати, що у рідкій ванні градієнт концентрації відсутній.
Таким чином, випаровування бінарного сплаву А-В в цих умовах матиме наступні особливості. У міру випаровування компонента В з більш високою пружністю пари знижується його вміст у рідинній і паровій фазах. Через певний проміжок часу tn так званого перехідного періоду концентрація компонента в рідинній ванні зменшиться до певної величини СпВ, і в паровій фазі дорівнюватиме вмісту у вихідному сплаві СоB. Подальше випаровування здійснюється в усталеному режимі, оскільки у міру випаровування заготовка пересувається вгору зі швидкістю, яка забезпечує постійний об'єм рідинної ванни і концентрацію СпВ.
Відбувається своєрідне підживлення рідинної ванни компонентом B. Склад пари і, відповідно, покриття дорівнює складу вихідного сплаву.
Для отримання однорідного покриття сплави з суттєво різним парціальним тиском компонентів випаровують з окремих незалежних джерел.
|
|
|
Випаровування таких сполук як оксиди, карбіди, бориди, силіциди, нітриди супроводжується зміною типу вихідних молекул. Для більшості тугоплавких сполук характерна дисоціація вихідних молекул з утворенням газоподібних продуктів. Наприклад, при випаровуванні рідинної фази АІ2О3 і ZгС утворюються наступні продукти дисоціації (в порядку зменшення об'ємної концентрації в газовій фазі):

Досвід показав, що практично без змін складу можуть бути отримані покриття сполук:
- оксиди - Аl2О3, Y2O3, МgO, ZrО2, SiО2;
- карбіди - ТiC, ZrС, NbС;
- бориди - ТіВ2, ZrВ2;
Інші сполуки, наприклад WС, SiC, АІN, ТІN, ZrN при нагріванні розпадаються з утворенням продуктів із різко відмінною летючістю і тому не можуть осаджуватись прямим випаровуванням.
Створення атомарних, молекулярних та іонних потоків при нанесенні вакуумних покриттів здійснюється також розпиленням твердого матеріалу без його переводу в рідкий стан. Для розпилення застосовують іонне бомбардування, оскільки іони легко довести до необхідної швидкості.
Падаючий іон вибиває атоми з вузлів кристалічної ґратки у результаті передачі імпульсу. Атоми, які знаходяться на поверхні матеріалу, одразу переходять у газоподібний стан, а атоми, які знаходяться на відстані від поверхні, передають імпульс іншим атомам ґратки, викликаючи каскад зіткнень.
Особливості зіткнення падаючого іона залежать від його енергії. Енергії іонів поділяють таким чином: високі - коли іон проходить поблизу від ядра, і взаємодія зводиться до кулонівського відштовхування; проміжні енергії - коли виявляється екрануюча дія електронних оболонок; малі енергії - коли має місце незначне проникнення в електронні оболонки.
Для початку процесу розпилення достатньо певного мінімального значення енергії іона, яка має назву порогової. Для більшості матеріалів порогова енергія розпилення змінюється у межах від 10 до 100 еВ і залежить від типу бомбардуючого іона, енергії зв'язку атомів у гратці матеріалу, який розпилюється. Зростання енергії іонів вище за порогове значення приводить до прискорення розпилення.
|
|
|
Інтенсивність розпилення характеризується коефіцієнтом розпилення, як відношення кількості розпилених атомів Nа до кількості бомбардуючих іонів Ni,:
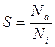 (5. 9)
(5. 9)
чи кількістю атомів речовини, вибитих одним іоном.
При фіксованій енергії бомбардуючого іона коефіцієнт розпилення залежить від атомного номера і структури електронних оболонок розпилюваного матеріалу. Так, у міру заповнення d-оболонок атомів розпилюваного матеріалу, коефіцієнт розпилення збільшується. Найбільші значення коефіцієнта розпилення мають атоми із заповненими d-оболонками, наприклад Сu, Аg, Сd, Аu. Аналогічна залежність спостерігається і у бомбардуючих іонів: максимальне розпилення викликають іони елементів із заповненими d-оболонками (Сu Аg, Сd, Ві, Рd, ТІ Нg Рt та ін. ) і р-оболонками (інертні гази). Максимальний коефіцієнт розпилення 84 аm/іон встановлений при розпиленні Cd іонами Сd+ (саморозпилення з енергією 45 еВ).
Вимірювання різними методами швидкості розпилених частинок показують, що їх енергія у багато разів перевищує енергію атомів при випаровуванні. Наприклад, середня енергія атомів міді, які випаровуються зі швидкістю 5∙ 1017 атомiв/(см2∙ с), при температурі 1500 К дорівнює 0, 26 еВ, у той час, коли атоми, які вибиті іонами Кг+ з енергією 900 еВ, мають середню енергію 9, 25 еВ. Ця енергія еквівалентна температурі 55000 К.
Величини E значно перевищують енергію сублімації, спостерігається характерна періодичність, яка відповідає періодичній системі елементів. Значення E мінімальне для елементів другої підгрупи (Zn, Сd, Тi). Найбільше значення E мають метали, коефіцієнт розпилення котрих мінімальний. Середня енергія вибитих атомів зростає з підвищенням енергії і зменшенням маси бомбардуючих іонів, тобто середня енергія розпилених частинок зростає зі збільшенням глибини проникнення іонів у речовину.
Коефіцієнт розпилення залежить від енергії, маси і кута падіння іонів.
Значення S, за експериментальними даними, отриманими за результатами втрати маси зразка, який опромінюється, може бути визначено:
 (5. 10)
(5. 10)
де ∆ m - втрати маси, мкг; А - масове число атомів зразка; j - іонний струм, мкА; t - час опромінювання.
Конденсатам, які отримані розпиленням, як правило, властиві більш досконала структура і висока адгезія до основи. Розпилення дозволяє отримувати багатокомпонентні системи без зміни хімічного складу конденсатів. Однаковий хімічний склад розпилюваної речовини і конденсату залишається також і у системах, компоненти котрих мають коефіцієнти розпилення, що суттєво відрізняються. Це пояснюється структурно-кінетичними закономірностями розпилення багатокомпонентних систем.
|
|
|
У перший момент розпилення з поверхні складного сплаву починає віддалятися компонент, коефіцієнт розпилення якого найбільший. На поверхні формується так званий змінений шар, обіднений компонентом з великим коефіцієнтом розпилення. Швидкість розпилення цього компонента уповільнюється, в той час, коли відносна швидкість розпилення другого зростає. Під час подальшого бомбардування процес стабілізується: розпилення сплаву супроводжується збереженням складу та товщини зміненого шару, який виконує роль автоматичного регулятора швидкостей розпилення. Відмінність у складі виникає, коли катод, який розпилюється, має достатньо високу температуру, близьку до температури плавлення. При цьому конденсат збагачується компонентом з найбільшим коефіцієнтом розпилення.
Випаровуваний чи розпилений атом при зіткненні з основою потрапляє в поле дії сил атомів, розташованих на її поверхні. Після зіткнення можливі три варіанти поведінки атома:
1) адсорбується і залишається на поверхні;
2) адсорбується, але через деякий час знову відривається від поверхні, тобто відбувається повторне випаровування - ревипаровування;
3) ударяється об поверхню і відштовхується від неї.
Ймовірність того, що атом утворює покриття, характеризує коефіцієнт конденсації - відношення кількості атомів, які конденсуються, до загальної кількості атомів, які доходять до поверхні:
 (5. 11)
(5. 11)
Після зіткнення з поверхнею атом обмінюється енергією. Обмін енергією характеризується коефіцієнтом термічної акомодації:
 (5. 12)
(5. 12)
де T0 - температура поверхні основи; T1, T2 - середні еквіваленти температури відповідно падаючих і відбитих атомів.
Температури T1 i T2 розраховують як кінетичну енергію атомів:

де w- середня швидкість; m - маса атома; К- стала Больцмана.
Якщо падаючий атом повністю віддає енергію основі (тобто T2 = T0), то аT = 1, і між атомом і поверхнею встановлюється термічна рівновага. За відсутності обміну Т1 = Т2 і тоді аT = 0. Тобто завжди коефіцієнт термічної акомодації знаходиться в межах від 0 до 1.
Якщо енергія атома велика, процес її поглинання не проходить швидко, й атом відбивається від поверхні або, навпаки, якщо енергія мала, атом, не маючи її залишку для переміщення по поверхні основи з метою знаходження стійкого положення, також відбивається від поверхні. Тому ймовірність захоплення атома велика, коли його енергія не перевищує величину Eа ≈ 25Ед (Ед - енергія десорбції).
Енергія десорбції приблизно дорівнює:
Eд ≈ 0, 5ЕS (5, 14)
де ES - енергія сублімації.
Для моноатомних парів металів Ед= 1... 4 еВ.
При зіткненні атом віддає свою енергію і прагне до теплової рівноваги з основою. Час, коли різниця температур адсорбованого атома й основи зменшується в е раз, називається часом релаксації й оцінюється співвідношенням:
tp  2/
2/  (5. 15)
(5. 15)
де V - частота коливань адсорбованого атома.
Якщо термічна рівновага встановлюється, то час знаходження атома на поверхні відносно до часу релаксації:
tз =  exp
exp 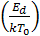 (5. 16)
(5. 16)
При tр ≥ t3 відбувається десорбція (атом не прилипає). Оскільки Ед= 1... 4 еВ, то час знаходження атома на поверхні завжди набагато більше від часу релаксації, навіть при високих значеннях температури основи (T0). Коли поверхня основи забруднена, Ед ≈ kT, і в цьому випадку може бути tр  t3. Тобто адсорбований атом не досягає термічної рівноваги і має температуру Т вище від температури поверхні основи (гарячий атом), а також має велику ймовірність ревипаровування.
t3. Тобто адсорбований атом не досягає термічної рівноваги і має температуру Т вище від температури поверхні основи (гарячий атом), а також має велику ймовірність ревипаровування.
Маючи залишок енергії, атом на поверхні може переміщуватись. Середнє значення відстані переміщення атома у стані адсорбції:
 =
=  (5. 17)
(5. 17)
де t- час переміщення у стані адсорбції; D - коефіцієнт дифузії адсорбованого атома:

де а - відстань між сусідніми положеннями рівноваги атома на шляху його переміщення; US - енергія активації, яка необхідна для переходу атома між двома сусідніми положеннями рівноваги. Після деяких перетворень отримаємо:
 = a exp
= a exp  (5. 18)
(5. 18)
Якщо відстань між двома сусідніми положеннями рівноваги атома (а) більше за середню довжину переміщення атома у стані адсорбції (λ ), то атом не переміщується по поверхні; при цьому виконується нерівність: Ед < US. У цьому випадку атом може покинути поверхню основи. Міграція починається, коли λ > а і, відповідно, Ед > US.
Якщо вважати Ед = 0, 5E, US= Е/6, E = 3 еВ, тоді при температурі 1000 К отримуємо λ S = 3·102·а, тобто атом може здійснити близько 300 перескоків по поверхні до десорбції. За цей час він зустрічається з іншими атомами і разом з ними утворює стійкий зародок чи приєднується до вже створеного зародка, що розростається.
Скупчення атомів, котрі затримуються у потенційних ямах на відстанях, кратних міжатомним відстаням основи, є початком утворення центрів-конденсації чи зародків нової фази.
Між атомами у скупченні починають діяти сили хімічного зв'язку, котрі прагнуть зблизити ці атоми в положення, які визначаються їх щільним розміщенням у відповідній кристалічній гратці.
Зародженням і ростом центрів конденсації починається формування покриття. Відрізняють наступні стадії росту покриття при конденсації пари.
На першій стадії виникають хаотично розташовані тривимірні зародки, котрі через деякий час перетворюються на острівці, їх форма залежить від поверхневої енергії і умов конденсації. Розростання острівців зменшує відстань між ними і у місцях зустрічі сусідніх острівців відбувається їх злиття - коалесценція. Внаслідок коалесценції формується розвинена мережа каналів, які не заповнені конденсуючою речовиною. Канали поступово зарощуються і перетворюються на окремі пори різноманітної форми. Кінцевим етапом є утворення суцільної плівки.
Масоперенесення при коалесценції відбувається за рахунок поверхневої дифузії, тому лімітуючим фактором цієї стадії є поверхнева дифузія, а рухаючою силою - мінімізація поверхневої енергії.
На зрощування острівців і формування покриття помітно впливає енергія атомів, що падають на поверхню основи. При відносно низьких температурах основи збільшення кінетичної енергії атомів пари, наприклад, при переході від термічного випаровування до катодного, прискорює зрощення острівців. Це пояснюється суттєвим збільшенням дифузійної рухомості за рахунок додаткової кінетичної енергії адсорбованих атомів. Зростання острівців прискорюється також із підвищенням температури основи, швидкості випаровування та конденсації.
Формування конденсованої плівки супроводжується виникненням великої кількості лінійних недосконалостей - дислокацій, їх щільність сягає 1010... 1011 см-2. Більшість дислокацій виникає на остаточних стадіях утворення суцільної плівки. Характерним виявом великої кількості дислокацій у тонких плівках є розвиток субструктури, яка впливає на їх властивості.
Температура поверхні конденсації - один з основних параметрів, який визначає структуру покриття.
Температурна залежність розмірів кристалітів D у кожній структурній зоні покриттів описується експонентою вигляду:
 (5. 20)
(5. 20)
де U - ефективна енергія активації процесів, що контролюють формування кристалітів (зерен).
Для чистих металів величина U в першій зоні має низькі значення порядку 0, 2... 0, 25 еВ. У другій зоні значення U близькі до значень енергії активації поверхневої самодифузії. Наприклад, для покриттів Fе, Ni, Ті, W значення U дорівнюють відповідно 0, 78; 0, 53; 0, 98; 3, 40 еВ. У третій зоні величини U приблизно дорівнюють енергії активації об'ємної самодифузії. Вказані значення енергії активації дозволяють одержати інформацію про механізми, які контролюють формування структури покриттів у кожній зі структурних зон.
Низькі значення енергії активації, які характерні для першої зони, відповідають значенням енергії активації переходу атомів між двома сусідніми положеннями рівноваги на поверхні US. Реалізація тільки цих переходів сприяє створенню куполоподібних зародків конденсації, котрі потім ростуть, створюючи конусоподібні кристали.
У другій структурній зоні розвивається більш складний механізм росту кристалів, який складається з двох послідовних процесів: створення критичних зародків і подальшого їх розростання по поверхні до зіткнення один з одним. Внаслідок цього створюються достатньо досконалі покриття з упорядкованим розташуванням лінійних недосконалостей у вигляді границь чи субграниць стовпчастих кристалів.
У третій зоні внаслідок високої енергії активації розвиваються процеси збиральної рекристалізації і росту зерна, що приводить до утворення рівноважної структури.
У товстих покриттях шари, які розташовані ближче до основи і більш тривалий час знаходяться при високих температурах, мають більш рівноважну структуру. Якщо нанесення покриттів здійснюється при температурі основи, тоді нижні шари матимуть рекристалізовану структуру, а верхні (більш холодні) - стовпчасту.
У покриттях сплавів типу твердих розчинів спостерігається більш дрібнозерниста структура порівняно з покриттями із чистих металів.
|
|
|


