 |
Хроматографічний метод аналізу
|
|
|
|
Хроматографічний метод аналізу
- За способом проведення хроматографічного аналізу розрізняють:
а) газову, рідинну, газорідинну хроматографію;
б) паперова та тонкошарова хроматографії;
в) колоночна і площинна хроматографії;
г) іонообмінна, колоночна, внутрішня хроматографії.
- Назвіть прийоми розділення речовин в колонках:
а) внутрішня, фронтальна та елюентна хроматографії;
б) розподільна, адсорбційна хроматографії;
в) газова, рідинна, паперова хроматографії;
г) колоночна, площинна хроматографії.
- Результатом рідинної хроматографії площинної хроматографії є:
а) внутрішня хроматографія;
б) фронтальна, елюент на хроматограми;
в) хроматограми на площині та папері;
г) елюентна, фронтальна, внутрішня хроматограми.
- Хроматографічні методи аналізу базуються на:
а) реакціях, що супроводжуються утворенням забарвлених розчинних сполук (іноді руйнуванням забарвлених сполук);
б) різному розподілу речовин між двома фазами залежно від їх адсорбційної здатності;
в) вимірюванні електропровідності розчину;
г). вимірюванні коефіцієнту заломлення світла.
- Метод розділення, виявлення та визначення речовин, базується на різному розподілу речовин між двома фазами, що не змішуються залежно від їх адсорбційної здатності:
а) хроматографія;
б) адсорбція;
в) екстракція;
г) люмінесценція.
- Процес пропускання розчинника крізь колонку називається:
а) елюірування;
б) хроматографічний;
в) розділення суміші;
г) елюент.
- Якщо компоненти суміші забарвлені, то їх розділення можна спостерігати візуально:
а) внутрішня хроматограма;
б) колон очна хроматографія;
в) елюентна хроматограма;
г) хроматограма.
|
|
|
- За механізмом розподілу речовин між фазами розрізняють:
а) газову, рідинну, газорідинну хроматографію;
б) колон очну та площинну хроматографію;
в) адсорбційну, колоночну, гель-фільтраційну хроматографію;
г) адсорбційну, розподільну, гель-фільтраційну хроматографію.
- До адсорбційної хроматографії належать:
а) колоночна, площинна, іонообмінна, тонкошарова, газоадсорбційна;
б) колоночна, іонообмінна, тонкошарова, газоадсорбційна;
в) розподільна, адсорбційна, гель-фільтраційна;
г) колоночна, хроматографія на папері, газова, газорідинна, площинна.
- Рухомою фазою в газорідинній хроматографії є:
а) газ (N2, He, H2);
б) рідина (досліджувана суміш);
в) тверда речовина;
г) рідина, нанесена на твердий носій.
- Нерухомою фазою в рідинній хроматографії є:
а) рідина з високою температурою кипіння що підтримується твердим носієм;
б) алкан з довгим ланцюгом, що нанесений на глинозем або вугілля;
в) тверда дрібнозерниста речовина;
г) рідина (досліджувана суміш).
- Як відбувається введення проби в газорідинній хроматографії:
а) пропускають розчин рідкий;
б) у вигляді пари;
в) вприскують рідину шприцом;
г) наносять на твердий носій.
- Результатом газорідинної хроматографії є:
а) газова хроматограма (послідовність піків);
б) внутрішня, елюентна, площинна, паперова хроматограми, іонообмінна хроматографія;
в) газова хроматограма, внутрішня, елюентна, високоефективна рідинна хроматографія;
г) внутрішня, елюент на, фронтальна хроматограми, хроматограма на папері та пластинці.
14. Просування суміші через поруватий носій відбувається під високим тиском відбувається в:
а) ВЕРХ;
б) колон очній хроматографії;
в) ТШХ, паперовій хроматографії;
г) рідинній хроматографії
- Просування суміші через поруватий носій відбувається під впливом сил тяжіння відбувається в:
а) високоефективній рідинній хроматографії;
|
|
|
б) колоночній хроматографії;
в) тонкошаровій хроматографії;
г) паперовій хроматографії.
Люмінесценція. Рефрактометрія. Потенціометрія
- Зміна напряму прямолінійного поширення світла при переході з одного середовища в інше:
а) заломлення світла;
б) світлопоглинання;
в) поляризація;
г) рефракція.
- Метод аналізу, який ґрунтується на визначенні показника заломлення досліджуваного розчину, називається:
а) флурометричним;
б) фотометричним;
в) потенціометричним;
г) рефрактометричним.
- Показник заломлення не залежить від:
а) довжини хвилі падаючого світла;
б) температури;
в) концентрації розчиненої речовини;
г) тиску (для газів).
- Для визначення показника заломлення використовують:
а) поляриметр;
б) фотометр;
в) рефрактометр;
г) спектрофотометр.
- Рефрактометричний метод аналізу використовують для визначення:
а) сухих речовин, ідентифікації речовин за значенням молекулярної рефракції, визначення зв’язаної вологи, визначення концентрації спирту в розчині;
б) масової частки сульфатів у розчині, вмісту заліза (ІІ) в солі Мора;
в) загальної твердості води, сухого залишку, вологості харчових продуктів;
г) сухих речовин, визначення вмісту іонів кальцію в молоці, окиснюваності води, сухого залишку.
- Світіння атомів, молекул та інших частинок, що виникає в результаті електронного переходу при повертанні із збудженого стану до основного:
а) люмінесценція;
б) хроматографія;
в) рефракція;
г) фотоефект.
- Втрата молекулою енергії у вигляді теплоти при зіткненні з другими частинками:
а) внутрішня конверсія;
б) фотолюмінесценція;
в) фосфоресценція;
г) флуоресценція.
- Повертання молекули на будь-який коливальний підрівень основного стану з випромінюванням енергії у вигляді кванта світла без зміни спіну електрону:
а) фотолюмінесценція;
б) внутрішня конверсія;
в) фосфоресценція;
г) флуоресценція.
- Перехід молекули із збудженого стану S1 у метастабільний стан Т1, а потім до основного стану S0:
а) фотолюмінесценція;
б) фосфоресценція;
в) флуоресценція;
г) внутрішня конверсія.
- Який вид люмінесценції найчастіше використовують в аналітичній хімії:
а) фотолюмінесценцію;
|
|
|
б) хемілюмінесценцію;
в) електролюмінісценцію;
г) біолюмінесценцію.
11. Для вимірювання флуоресценції використовують:
а) флуорометри;
б) спектрофлуориметри;
в) фосфориметри;
г) поляриметри.
- До переваг люмінесцентного аналізу не належить:
а) тушіння люмінесценції;
б) чутливість методу;
в) селективність;
г) вимірювання самого сигналу.
- Для яких визначень не застосовують люмінесценцію:
а) визначення ступеня свіжості м’яса та його видової належності;
б) визначення сухих речовин;
в) визначення вологості харчових продуктів;
г) визначення домішок у напівпровідникових матеріалів, вітамінів, ліків, наркотиків.
- Рівняння, що зв’язує рівноважний електродний потенціал з концентраціями реагуючих речовин:
а) рівняння Нернста;
б) рівняння Менделєєва - Клапейрона;
в) закон Бугера – Ламберта - Бера;
г) закони Фарадея.
- Величина електродного потенціалу не залежить від:
а) температури;
б) тиску;
в) активності іонів у розчині ( молярної концентрації);
г) природи металу та природи розчинника.
16. Знайдіть вираз рівняння Нернста:
а) ЕРС = Е+ - Е-;
б)  ;
;
в) Е = Е0 +  ;
;
г) 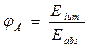 .
.
- Електрогравіметричні методи аналізу базуються на вимірюванні:
а) кількості продукту реакції, реактив – електрони, які підводяться до поверхні електрода;
б) кількості реагенту, витраченого на титрування;
в) кількості виділеного продукту в результаті хімічної реакції;
г) безпосереднє вимірювання електрохімічних властивостей досліджуваної речовини.
- До електрогравіметричних методів аналізу не належать:
а) потенціометрія;
б) внутрішній електроліз;
в) електролітичне осадження металів;
г) електролітичне розділення металів за допомогою ртутного катоду.
- Метод визначення точки еквівалентності за зміною окислювального потенціалу індикаторного електрода :
а) потенціометрія;
б) кондуктометрія;
в) потенціометричне титрування;
г) амперметричне титрування.
20. Метод визначення точки еквівалентності за зміною електропровідності розчину :
а) потенціометричне титрування;
|
|
|
б) кондуктометричне титрування;
в) амперметричне титрування;
в) потенціометрія.
- Метод, який базується на вимірюванні потенціалу індикаторного електрода, зануреного в досліджуваний розчин. Точку еквівалентності визначають за зміною електродного потенціалу в кінцевій точці титрування:
а) потенціометричне титрування;
б) кондуктометричне титрування;
в) амперметричне титрування;
г) електрогравіметрія.
- Електрод вимірювання, потенціал його залежить від концентрації досліджуваних іонів у розчині:
а) індикаторний електрод;
б) інертний електрод;
в) електрод порівняння;
г) стандартний електрод.
- Який електрод найчастіше використовують як індикаторний електрод при потенціометричному визначенні рН розчинів:
а) мідний;
б) ртутний;
в) скляний;
г) хінгідронний.
- Для визначення рН розчинів використовують:
а) рефрактометр;
б) потенціометр, рН-метр;
в) поляриметр;
г) фотоелектроколориметр.
- До потенціометричних методів належать:
а) катіонометрія, аніонометрія;
б) іонометрія, потенціометричне титрування, потенціометрія;
в) амперометрія, потенціометрія, потенціометричне титрування, кондуктометричне титрування;
г) тільки потенціометрія та потенціометричне титрування.
26. Основне застосування потенціометрії:
а) потенціометричне визначення кислотності середовища;
б) для визначення концентрації забарвлених і каламутних розчинів, що містять суміші речовин без їх попереднього розділення;
в) для визначення розчинності та добутку розчинності важкорозчинних сполук;
г) для визначення концентрації вітамінів, гормонів, амінокислот.
|
|
|


