 |
Ионизация электроспрея (ESI)
|
|
|
|
Идея электроспрея, хоть и не нова, была возрождена в связи с её настоящим применением к биомолекулам. Первые эксперименты с электроспреем были проведены Чепменом в поздних 1930-х, а практическое развитие ионизации электроспрея для масс-спектрометрии было завершено Доулом в поздних 1960-х. Доул также открыл важное явление множественной зарядки молекул. Работы Фенна окончательно привели к современной технике ионизации электроспрея в масс-спектрометрии и её применению для биологических молекул.
Суть ESI заключается в следующем. Электрическое напряжение на игле приводит к большому электрическому градиенту на жидкости, который разделяет заряды на поверхности. Это вынуждает жидкость выпячиваться с иглы в форме конуса Тейлора. Верхушка конуса вытягивается в нить до тех пор, пока не достигнет предела Рэлея, при котором поверхностное натяжение и электростатическое отталкивание сравняются и сильно заряженная капля не оторвётся от нити. Капли, которые оторвались от конуса, притягиваются к входу в масс-спектрометр из-за большой разности потенциалов между иглой и входом в масс-анализатор. По мере продвижения капли к анализатору кулоновское отталкивание на поверхности превосходит поверхностное натяжение и капля «взрывается», окончательно высвобождая ионы. [3]
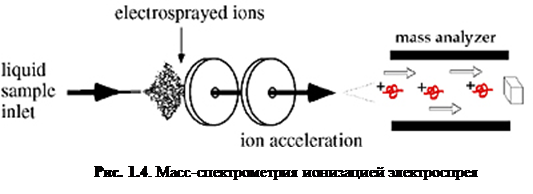
Ионизация электроспрея – метод, который обычно применяется для пептидов, белков, углеводов, малых олигонуклеотидов, синтетических полимеров и липидов. ESI производит газообразные заряженные молекулы прямо из жидкого раствора. Ионизация происходит при создании тонкого спрея сильно заряженных капель в присутствии электрического поля. Образец раствора распыляется из области с сильным электрическим полем на конце металлической форсунки, поддерживаемой при потенциале между 700 и 5000 В. Форсунка (или игла), к которой приложен потенциал, служит для распыления раствора в тонкий спрей заряженных капель. Использование сухого газа, нагревания или оба этих способов применяется к заряженным каплям при атмосферном давлении для испарения из них растворителя. С уменьшением размера капель возрастает плотность заряда на их поверхности. Взаимное кулоновское отталкивание между одинаковыми зарядами на этой поверхности становится настолько велико, что превосходит силы поверхностного натяжения и ионы вырываются из капли через «конус Тейлора» - рис. 1.5. Другая возможность состоит в том, что капля взорвётся, высвобождая ионы. В любом случае свободные ионы направляются в канал через электростатические «линзы», направляясь в вакуум масс-анализатора. Так как ESI включает в себя непрерывную подачу раствора, он применим для использования совместно с ВЭЖХ или капиллярным электрофорезом. [4]
|
|
|
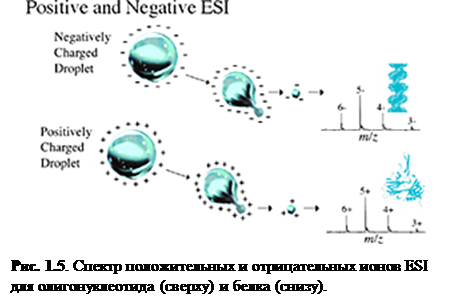 |
Ионизация электроспрея благоприятствует образованию единично заряженных малых молекул, но также хорошо известно образование в ходе неё многократно заряженных экземпляров больших молекул. Это важное явление, т.к. масс-спектрометр измеряет отношение массы к заряду (m / z) и поэтому многократная зарядка делает возможным наблюдать очень большие молекулы при помощи инструмента с относительно малым диапазоном масс. К счастью, программы, пригодные для всех масс-спектрометров с электроспреем, позволяют произвести вычисления молекулярной массы, необходимые для определения действительной массы многозарядных образцов. Рис. 1.6 и 1.7 показывают различные заряженные состояния двух различных белков, где каждый пик в масс-спектрах может быть соотнесён с различными зарядовыми состояниями молекулярного иона. Многократная зарядка имеет другие важные преимущества в тандемной масс-спектрометрии. Одно из преимуществ состоит в том, что после фрагментации вы наблюдаете больше фрагментарных ионов от многозарядного предшественника, чем от однозарядного.
|
|
|
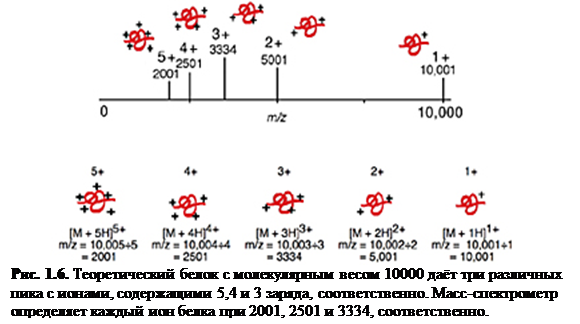
Многократная зарядка: белок с массой 10000 дальтон и его теоретический масс-спектр с зарядами до +5 показаны на рис. 1.8. Масса белка остаётся такой же в то время, как отношение m / z меняется в зависимости от числа зарядов на белке. Ионизация белка есть обычно результат протонирования, что не только добавляет заряд, но также увеличивает массу белка на число добавленных протонов. Это действие на m / z применимо одинаково для любого механизма ионизации молекулы, образовавшего положительно или отрицательно заряженный молекулярный ион, включая присоединение или отрыв несущих заряд частиц, отличных от протона (например, Na+ и Cs+). Многократные положительные заряды наблюдаются для белков, в то время как для олигонуклеотидов типично образование отрицательных зарядов (с ESI).
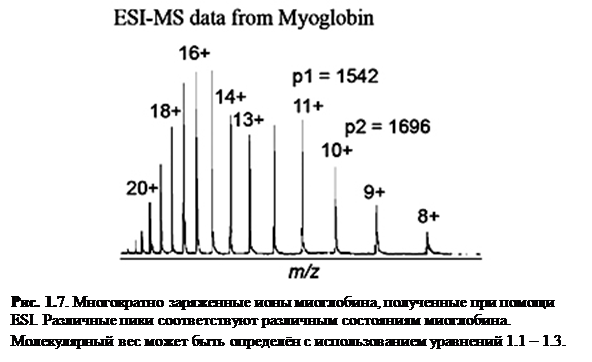 |
Хотя масс-спектрометры электроспрея снабжены программами, которые подсчитывают молекулярный вес, понимание, как компьютер производит эти вычисления для многократно-заряженных ионов полезно. Уравнения 1.1 – 1.5 и рис. 1.9 представляют простое объяснение, где мы принимаем, что пики p1 и p2 являются соседними и различаются одним зарядом, что эквивалентно добавлению одного протона.
| p = m/z p1 = (Mr + z1)/z1 p2 = {Mr + (z1 - 1)}/(z1 - 1) | (1.1) (1.2) (1.3) |
| p – пик в масс-спектре m – общая масса иона z – полный заряд Mr – средняя масса белка | p1 – значение m/z для p1 p2 – значение m/z для p2 z1 – заряд для пика p1 |
| Уравнения 1.2. и 1.3. могут быть решены для двух неизвестных, Mr и z1. Для пиков в масс-спектре миоглобина, показанном на рис. 1.9, p1=1542, p2=1696. | |
| 1542 z1 = Mr + z1 1696 (z1 - 1) = Mr + (z1 - 1) Решив два уравнения, находим: Mr = 16,951 Da для z1 = 11 | (1.4) (1.5) |
|
|
|


