 |
Лазерная десорбция/ионизация при помощи матрицы (MALDI)
|
|
|
|
Масс-спектрометрия с лазерной десорбцией/ионизацией при помощи матрицы (MALDI-MS) впервые была использована в 1988 году Танакой, Карасом и Хилленкампом. С тех пор он стал широко распространённым методом для пептидов, белков и большинства других биомолоекул (олигонуклеотидов, углеводов, природных веществ и липидов). Эффективный и направленный перенос энергии во время акта индуцированной лазером десорбции при помощи матрицы приводит к большому выходу ионов незатронутого аналита и позволяет проводить измерения соединений с субпикомолярной чувствительностью. Вдобавок, удобство MALDI для анализа гетерогенных образцов делает его очень привлекательным для масс-анализа сложных биологических образцов, как, например, гидролизат белков.
 |
Хотя точный механизм десорбции/ионизации для MALDI неизвестен, принято считать, что MALDI вызывает ионизацию и перевод образца из конденсированной фазы в газовую посредством лазерного возбуждения и индивидуализации молекул образца из матрицы (рис. 1.14). В MALDI анализе аналит сначала сокристаллизуется с большим молярным избытком матричного соединения, обычно УФ-поглощающей слабой органической кислотой. Облучение такой смеси аналита с матрицей лазером приводит к испарению матрицы, которая несёт аналит в себе. Матрица играет ключевую роль в этом методе. Сокристаллизованные молекулы образца также испаряются, но без прямого поглощения энергии лазера. Молекулы, чувствительные к лазерному излучению, поэтому защищены от прямого возбуждения УФ-лазером.
Матрица MALDI – нелетучий твёрдый материал, обеспечивающий процессы десорбции и ионизации посредством поглощения лазерного излучения. Как результат, и матрица, и любой образец, встроенный в неё, испаряются. Матрица также служит для того, чтобы минимизировать ущерб образцу от лазерного излучения, поглощая большую часть падающей энергии.
|
|
|
Оказавшись в газовой фазе, десорбированные заряженные молекулы затем электростатически направляются из MALDI устройства ионизации в масс-анализатор. Времяпролётные (TOF) масс-анализаторы часто используются для разделения ионов по отношению массы к заряду (m / z). Импульсная природа MALDI очень удобна для TOF анализаторов, т.к. начальный момент времени можно засекать как момент лазерного импульса.
Было разработано несколько теорий для объяснения десорбции посредством MALDI. Модель термических пиков предполагает, что выброс неповреждённых молекул обусловлен слабым колебательным взаимодействием между матрицей и аналитом, что минимизирует перенос колебательной энергии от матрицы к модам молекул аналита, тем самым минимизируя фрагментацию. Теория импульсного давления предполагает, что создаётся градиент давления, перпендикулярный поверхности, и десорбция больших молекул вызвана передачей импульса при их столкновениях с быстро движущимися молекулами матрицы. Обычно считается, что ионизация происходит посредством передачи протона или катионизации во время процесса десорбции.
Полезность MALDI для анализа биомолекул основана на её способности давать информацию о молекулярном весе неповреждённых молекул. Способность давать точную информацию может быть чрезвычайно важна для определения и характеристики белков. Например, белок часто может быть однозначно определён точным анализом масс составляющих его пептидов (полученных химическим или же ферментативным воздействием на образец). [4]
| Таблица 1.4. Преимущества и недостатки метода лазернойдесорбции/ионизации при помощи матрицы (MALDI). | ||||||||
| ||||||||
Приготовление образца и матрицы оказывает значительное влияние на качество масс-спектров MALDI белков и пептидов (рис. 1.15). Среди большого разнообразия известных методов приготовления наиболее часто употребляемым является метод высушенной капли. В этом случае насыщенный раствор матрицы смешивается с раствором аналита так, чтобы соотношение матрицы к аналиту было около 5000:1. Аликвота (0.5-2.0 мкл) такой смеси затем помещается на место образца, где затем высушивается. Ниже приведена методика такого приготовления:
· отобрать пипеткой 0.5 мкл образца на подложку;
· отобрать пипеткой 0.5 мкл матрицы на подложку;
· перемешать образец и матрицу втягиванием их в пипетку и выпусканием;
· позволить высохнуть на воздухе.
§ Для пептидов, небольших белков и большинства других соединений: насыщенный раствор α-циано-4-гидроксикоричной кислоты в 50:50 ацетонитрил:вода с 0.1% ТФА.
§ Для белков и других тяжёлых молекул: насыщенный раствор синапиновой кислоты в 50:50 ацетонитрил:вода с добавлением 0.1% ТФА.
§ Для гликопептидов/белков и маленьких соединений: насыщенный раствор 2,5-дигидроксибензойной кислоты (DHB) в 50:50 ацетонитрил:вода.
Рис. 1.15. Обычно используемые в MALDI матрицы и подложка для MALDI с показанным расположением матрицы. Одним из преимуществ MALDI является то, что множество образцов может быть подготовлено в одно и то же время, как видно по этой многообразцовой подложке.
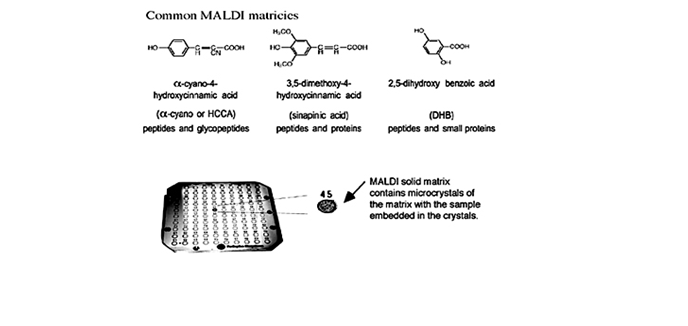
Также образцы могут быть приготовлены последовательным способом. В тонкослойном методе сначала на цель наносится гомогенная «плёнка» матрицы, а затем туда добавляется образец, который абсорбируется ей. Этот метод даёт хорошую чувствительность, разрешающую способность и точность определения. Аналогично, в толстослойном методе нитроцеллюлоза (NC) используется как добавка к матрице. После образования единого слоя NC-матрица на цели добавляется образец. Этот метод приготовления предотвращает образования щелочных аддуктов и значительно увеличивает чувствительность определения, особенно для пептидов и белков, экстрагированных из гелей. Сэндвичевый метод – другой вариант в этой категории. Тонкий слой кристаллов матрицы приготовляется как в тонкослойном методе, затем последовательно добавляются капли (a) водного 0.1% ТФА, (b) образца и (c) матрицы.
|
|
|
|
|
|


