 |
Общие свойства аминокислот
|
|
|
|
Макасеева О.Н., Дудинская, О.В., Ткаченко Л.М., Ильичева Н.И.
Р… Биологическая химия. Раздел «Белки и нуклеиновые кислоты»: конспект лекций /О.Н. Макасеева, О.В. Дудинская, Л.М. Ткаченко, Н.И. Ильичева. – Могилев: МГУП, 2014. – …… с.
ISBN ……978-985-6979-70-8 ……
ISBN …….978-985-6979-69-2.
Конспект лекций по дисциплине «Биологическая химия». Раздел «Белки и нуклеиновые кислоты» является дополнительным источником, который поможет студентам всех форм обучения освоить данную дисциплину. Конспект лекций содержит основные темы раздела «Белки и нуклеиновые кислоты» курса в соответствии с учебной программой.
Предназначается для студентов технологических специальностей пищевой промышленности.
УДК…. 547
ББК…. 24.2
| …ISBN 978-985-6979-70-8 (Ч. 1) …ISBN 978-985-6979-69-2 | © О.В. Дудинская, Л.М. Ткаченко, Н.И. Ильичева.2014 © Учреждение образования «Могилевский государственный университет продовольствия», 2014 |
Содержание
1 АМИНОКИСЛОТЫ.. 4
1.1 Строение аминокислот. 4
1.2 Классификация аминокислот. 7
1.3 Общие свойства аминокислот. 9
1.3.1 Оптические свойства. 9
1.3.2 Кислотно-основные свойства аминокислот. Изоэлектрическая точка. 10
1.3.1 Химические свойства аминокислот. 14
1.3.2 Реакция меланоидинообразования. 14
2 ПЕПТИДЫ.. 16
3 БЕЛКИ.. 20
3.1 Функции белков. 20
3.2 Строение белковой молекулы.. 23
3.3 Физико-химические свойства белков. 34
3.3.1 Амфотерные свойства белков. Изоэлектрическая точка белков. 34
3.3.2 Денатурация белков. 34
3.3.3 Гидрофильные свойства белков. Высаливание белков. 37
3.4 Методы выделения белков. 40
3.5 Классификация белков. 43
4 НУКЛЕИНОВЫЕ КИСЛОТЫ.. 46
4.1 Состав нуклеиновых кислот. 46
4.2 Нуклеозиды.. 49
4.3 Нуклеотиды.. 51
4.4 Первичная структура нуклеиновых кислот. 54
|
|
|
4.5 Вторичная и третичная структуры ДНК.. 55
4.6 Структура РНК.. 59
Рекомендуемая литература. 62
АМИНОКИСЛОТЫ
Строение аминокислот
Основной структурной единицей белков являются a-аминокислоты. В природе известно свыше 300 аминокислот, однако в состав белков входит лишь 20 a-аминокислот (одна из них – пролин, является не амино -, а имино кислотой), получивших название белковых, или протеиногенных, аминоктслот (см. Таблица 1). Все другие аминокислоты существуют в свободном состоянии или в составе коротких пептидов, или комплексов с другими органическими веществами.
a-Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом у a-углеродного атома замещен на аминогруппу (–NН2), например:
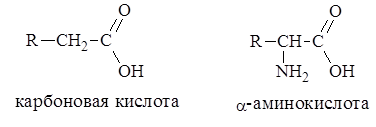
Различаются аминокислоты строением и свойствами радикалов ®. Радикалы аминокислот могут быть алифатическими, ароматическими и гетероциклическими. Благодаря этому каждая аминокислота наделена специфическими свойствами, определяющими химические, физические свойства и физиологические функции белков в организме.
Именно благодаря радикалам аминокислот, белки обладают рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Значительно реже в живых организмах встречаются аминокислоты с b- или g-положением аминогруппы, например:
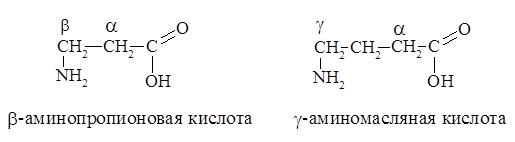
Кроме 20 стандартных аминокислот, встречающихся почти во всех белках, существуют еще нестандартные аминокислоты, являющиеся компонентами лишь некоторых типов белков – эти аминокислоты называют еще модифицированными. Около 150 из них уже выделены. Эти аминокислоты образуются после завершения синтеза белка в рибосоме клеток путем посттрансляционной химической модификации.
Таблица №1 – Строение протеиногенных аминокислот
| № | Строение аминокислоты | Сокращен. название | Название |
| 1. | 
| Гли | Глицин |
| 2. | 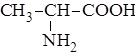
| Ала | Аланин |
| 3. | 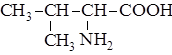
| Вал | Валин |
| 4. | 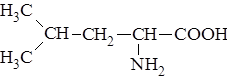
| Лей | Лейцин |
| 5. | 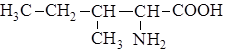
| Иле | Изолейцин |
| 6. | 
| Сер | Серин |
| 7. | 
| Тре | Треонин |
| 8. | 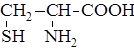
| Цис | Цистеин |
| 9. | 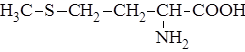
| Мет | Метионин |
| 10. | 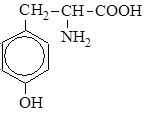
| Тир | Тирозин |
| 11. | 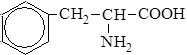
| Фен | Фенилаланин |
| 12. | 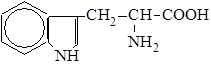
| Три | Триптофан |
| Продолжение таблицы 1 | |||
| 13. | 
| Асп | Аспарагиновая кислота |
| 14. | 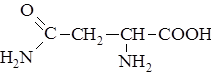
| Асн | Аспарагин |
| 15. | 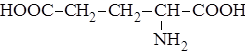
| Глу | Глутаминовая кислота |
| 16. | 
| Глн | Глутамин |
| 17. | 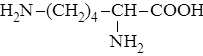
| Лиз | Лизин |
| 18. | 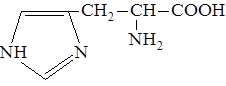
| Гис | Гистидин |
| 19. | 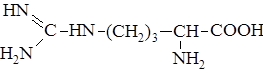
| Арг | Аргинин |
| 20. | 
| Про | Пролин |
|
|
|
Один из примеров особенно важной модификации – окисление двух-SН–групп цистеиновых остатков с образованием аминокислоты цистина, содержащей дисульфидную связь. Так же легко происходит и обратный переход.

Таким путем образуется одна из важнейших окислительно-восстановительных систем живых организмов. В больших количествах цистин содержится в белках злаковых – клейковине, в белках волос, рогов.
Другие примеры аминокислотной модификации - гидроксипролин и гидроксилизин, которые входят в состав коллагена-основного белка соединительной ткани животных.
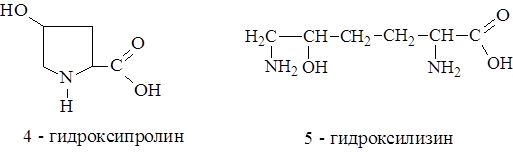
В состав белка протромбина (белок свертывания крови) входит
g-карбоксиглутаминовая кислота, а в ферменте глутатионпероксидазе открыт селеноцистеин, в котором (S) сера заменена на (Se) селен.
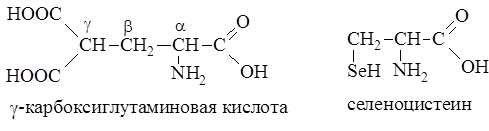
Классификация аминокислот
Существует несколько видов классификаций аминокислот входящих в состав белка.
В основу первой классификации положено химическое строение радикалов аминокислот. Различают аминокислоты:
- алифатические – глицин, аланин, валин, лейцин, изолейцин, лизин;
- гидроксилсодержащие – серин, треонин;
- серосодержащие – цистеин, метионин;
- ароматические – фенилаланин, тирозин, триптофан;
- гетероциклические – пролин, гистидин;
Второй вид классификации основан на полярности R-групп аминокислот. Различают:
- неполярные (гидрофобные) аминокислоты, у которых в радикале есть неполярные связи между атомами С–С, С–Н, таких аминокислот восемь: глицин, аланин, валин, лейцин, изолейцин, фенилаланин, триптофан, пролин;
- полярные незаряженные (гидрофильные) аминокислоты, у которых в радикале есть полярные связи между атомами С–О, С–N, О–Н, S–H, таких аминокислот пять: серин, треонин, метионин, аспарагин, глутамин;
|
|
|
- полярные отрицательно заряженные аминокислоты, у которых в радикале есть группы, которые в водной среде при рН=7 несут отрицательный заряд, таких аминокислот четыре: тирозин, цистеин, аспарагиновая кислота, глутаминовая кислота;
- полярные положительно заряженные аминокислоты, у которых в радикале есть группы, которые в водной среде при рН=7 несут положительный заряд, таких аминокислот три: лизин, аргинин, гистидин.
Чем больше в белке аминокислот с полярными группами, тем выше его реакционная способность. От реакционной способности во многом зависят функции белка. Особенно большим числом полярных групп, характеризуются ферменты. И наоборот, их очень мало в таком белке как кератин (волосы, ногти).
Таблица 2 – Классификация аминокислот на основе полярности
R-групп
| Аминокислоты | Принятые однобуквенные обозначения и символы | Изоэлектрическая точка, рI | Среднее содержание в белках,% | ||
| Англ. | символ | Русск. | |||
| 1. Неполярные R-группы | |||||
| Глицин | GLy | G | Гли | 5,97 | 7,5 |
| Аланин | ALa | A | Ала | 6,02 | 9,0 |
| Валин | VaL | V | Вал | 5,97 | 6,9 |
| Лейцин | Leu | L | Лей | 5,97 | 7,5 |
| Изолейцин | Lie | I | Иле | 5,97 | 4,6 |
| Пролин | Pro | P | Про | 6,10 | 4,6 |
| Фенилаланин | Phe | F | Фен | 5,98 | 3,5 |
| Триптофан | Trp | W | Трп | 5,88 | 1,1 |
| 2. Полярные, незаряженные R-группы | |||||
| Серин | Ser | S | Сер | 5,68 | 7,1 |
| Треонин | Thr | T | Тре | 6,53 | 6,0 |
| Метионин | Met | M | Мет | 5,75 | 1,7 |
| Аспарагин | Asn | N | Асн | 5,41 | 4,4 |
| Глутамин | GLn | Q | Глн | 5,65 | 3,9 |
| 3. Отрицательно заряженные R-группы | |||||
| Тирозин | Tyr | Y | Тир | 5,65 | 3,5 |
| Цистеин | Cys | C | Цис | 5,02 | 2,8 |
| Аспарагиновая к-та | Asp | D | Асп | 2,97 | 5,5 |
| Глутаминовая к-та | GLy | E | Глу | 3,22 | 6,2 |
| Продолжение таблицы 2 | |||||
| 4. Положительно заряженные R-группы | |||||
| Лизин | Lys | K | Лиз | 9,74 | 7,0 |
| Аргинин | Arg | R | Арг | 10,76 | 4,7 |
| Гистидин | His | N | Гис | 7,59 | 2,1 |
Третий вид классификации основан на количестве аминных и карбоксильных групп аминокислот. Они делятся на моноаминамонокарбоновые, содержащие по одной карбоксильной и амино- группе; моноаминодикарбоновые (две карбоксильные и одна амино-группа); диаминомонокарбоновые (две амино- и одна карбоксильная группа).
|
|
|
Четвертый вид классификации основан на способности аминокислот синтезироваться в организме человека и животных. Все аминокислоты делятся на заменимые, незаменимые и частично незаменимые.
Незаменимые аминокислоты не могут синтезироваться в организме человека и животных, они обязательно должны поступать вместе с пищей. Абсолютно незаменимых аминокислот восемь: валин, лейцин, изолейцин, треонин, триптофан, метионин, лизин, фенилаланин.
Частично незаменимые - синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются арганин, гистидин.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве из других соединений. Растения могут синтезировать все аминокислоты.
Общие свойства аминокислот
Оптические свойства
В молекулах всех природных аминокислот (за исключением глицина) у a-углеродного атома все четыре валентные связи заняты различными заместителями, такой атом углерода является асимметрическим, и получил название хирального атома. Вследствие этого растворы аминокислот обладают оптической активностью – вращают плоскость плоскополяризованного света. Причем, при прохождении через них поляризованного луча происходит поворот плоскости поляризации либо в право (+), либо влево (–). По расположению атомов и атомных группировок в пространстве относительно асимметрического атома различают L - и D -стереоизомеры аминокислот. Знак и величина оптического вращения зависят от природы боковой цепи аминокислот (R-группы).
Число возможных стереоизомеров N=2n, где n – число асимметрических атомов углерода. У глицина n = 0, у треонина n = 2. Все остальные 17 белковых аминокислот содержат по одному асимметрическому атому углерода, они могут существовать в виде двух оптических изомеров.
В качестве стандарта при определении L и D -конфигураций аминокислот используется конфигурация стереоизомеров глицеринового альдегида.
Расположение в проекционной формуле Фишера NH2-группы слева соответствуют L -конфигурации, а справа – D -конфигурации.
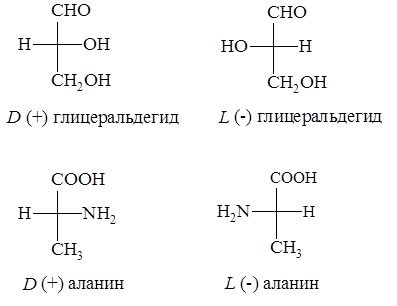
Следует отметить, что буквы L и D означают принадлежность того или иного вещества по своей стереохимической конфигурации к L или D ряду, независимо от направленности вращения.
В составе белков обнаруживаются только L -изомеры аминокислот.
D -формы аминокислот в природе встречаются редко и обнаружены лишь в составе белков клеточной стенки (гликопротеинов) некоторых бактерий и в пептидных антибиотиках (грамицидин, актиномицин и т.д.). L -формы хорошо усваиваются растениями и животными и легко включаются в обменные процессы. D- формы не ассимилируются этими организмами, а иногда даже ингибируют процессы обмена. Это объясняется тем, что ферментативные системы организмов специфически приспособлены к L формам аминокислот.
|
|
|
L и D формы аминокислот оказывают различное физиологическое воздействие на организм человека – различаются по вкусу: D- изомеры сладкие, L -формы горькие или безвкусные.
|
|
|


