 |
Исследование других органов 1 глава
|
|
|
|
Функция возбудимости
Функция возбудимости — это способность клеток проводящей системы сердца и сократительного миокарда возбуждаться под влиянием внешних электрических импульсов. Возбуждение сердечной мышцы сопровождается возникновением трансмембранного потенциала действия (ТМПД) — изменяющейся разности потенциалов между наружной и внутренней поверхностями клеточной мембраны. В исходном состоянии наружная поверхность невозбужденной миокардиальной клетки заряжена положительно, а внутренняя — отрицательно (рис. 1.9). Различают несколько фаз ТМПД миокардиальной клетки.
| Рис. 1.9. Трансмембранный потенциал действия (ТМПД). Объяснение в тексте. АРП и ОРП — абсолютный и относительный рефрактерные периоды | 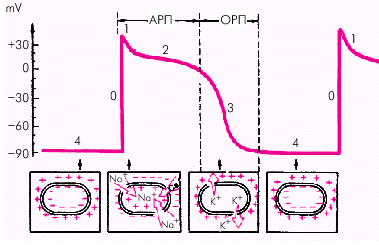
|
Фаза 0 — во время которой происходит быстрая (в течение 0,01 с) перезарядка клеточной мембраны: внутренняя ее поверхность заряжается положительно, а наружная отрицательно.
Фаза 1 — небольшое начальное снижение ТМПД от +20 мV до 0 или чуть ниже (фаза начальной быстрой реполяризации).
Фаза 2 — относительно продолжительная (около 0,2 с) фаза плато, во время которой величина ТМПД поддерживается на одном уровне.
Фаза 3 (конечной быстрой реполяризации), в течение которой восстанавливается прежняя поляризация клеточной мембраны: наружная ее поверхность заряжается положительно — а внутренняя — отрицательно (–90 мV).
Фаза 4 (фаза диастолы). Величина ТМПД сократительной клетки сохраняется примерно на уровне –90 мV. Происходит восстановление исходной концентрации К+, Na+, Ca2+ и Cl–, благодаря работе Na+-К+-насоса.
В разные фазы ТМПД возбудимость мышечного волокна различна. В начале ТМПД (фазы 0, 1, 2) клетки полностью не возбудимы (абсолютный рефрактерный период). Во время быстрой конечной реполяризации (фаза 3) возбудимость частично восстанавливается (относительный рефрактерный период). Во время диастолы (фаза 4 ТМПД) рефрактерность отсутствует и миокардиальное волокно полностью возбудимо (рис. 1.9).
|
|
|
Функция сократимости
Функция сократимости — это способность сердечной мышцы сокращаться в ответ на возбуждение. Этой функцией обладает в основном сократительный миокард. Процесс сокращения запускается ионами Ca2+,входящими в клетку во время ТМПД. Во время реполяризации мембраны происходит удаление ионов кальция из клетки в межклеточную жидкость, в результате чего наступает расслабление мышечного волокна. В результате последовательного сокращения и расслабления различных отделов сердца осуществляется основная — насосная функция сердца. Рассмотрим подробнее процесс сокращения сердечной мышцы.
Миокард состоит из множества отдельных поперечнополосатых мышечных клеток — кардиомиоцитов — волокон, торцевые части которых плотно стыкуются друг с другом с помощью так называемых вставочных дисков — нексусов, обладающих очень низким электрическим сопротивлением. Такая структура обеспечивает быстрое распространение волны возбуждения от одной клетки к другой и, соответственно, почти одновременное их сокращение (функциональный синцитий) (рис. 1.10, а).
Каждый кардиомиоцит состоит из большого числа переплетающихся между собой нитей миофибрилл, которые тянутся по всей длине мышечного волокна (рис. 1.10, б). Между миофибриллами располагается ядро клетки, митохондрии, а также внутриклеточная система мембран клеток. Окружает миоцит сарколемма, которая образует множество складок и карманов, идущих как в продольном, так и в поперечном направлениях, в том числе — глубоких каналоподобных выпячиваний сарколеммы внутрь клетки (Т-трубочек).

|
| Рис. 1.10. Строение кардиомиоцита. а — функциональный синцитий; б — кардиомиоцит, состоящий из миофибрилл; в — саркомер; г — структура саркомера (схема). Объяснение в тексте |
Саркоплазматический ретикулум кардиомиоцитов — это глубокая сеть внутриклеточных канальцев, анастомозирующих между собой и тесно прилегающих к поверхностной мембране (сарколемме) и Т-трубочкам (рис. 1.11). Это обеспечивает быстрое распространение возбуждения сарколеммы и Т-трубочек на мембраны саркоплазматического ретикулума, что сопровождается лавинообразным выходом ионов Са2+ из ретикулума
|
|
|
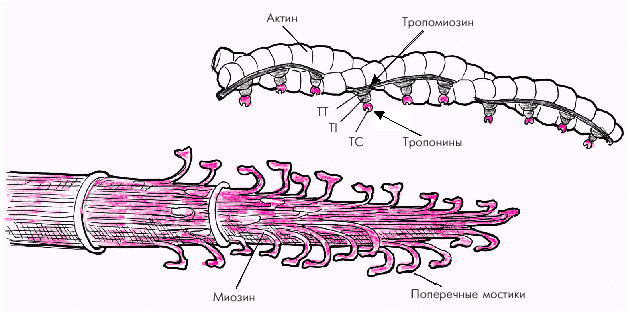
Миофибриллы кардиомиоцитов делятся на периодически повторяющиеся саркомеры, которые представляют собой структурную и функциональную единицу сокращения (см. рис. 1.10, в, г). Каждый саркомер с обеих сторон ограничен темными линиями (так называемыми Z-линиями), тесно связанными с Т-трубочками сарколеммы. Саркомер состоит из тонких нитей (молекул актина) и толстых нитей (молекул миозина), взаимодействие между которыми лежит в основе сокращения кардиомиоцитов.
Толстые нити состоят из длинных молекул миозина, скрученных в спираль и образующих поперечные мостики, выступающие в сторону тонких нитей актина (рис. 1.12). Поперечные мостики содержат миофибриллярную АТФ-азу и обладают способностью образовывать обратимые связи с молекулами актина.
Тонкие нити саркомера состоят из двух скрученных в спираль цепей молекул актина, тесно связанных с регуляторными белками — тропомиозином и тропонином (рис. 1.12). Актин способен образовывать соединения с миозином в присутствии АТФ и ионов магния, которые активируют АТФ-азу миозина. Регуляция такого соединения обеспечивается главным образом тропонином С, который обладает высоким сродством к ионам Са2+. Когда мышечное волокно находится в состоянии покоя и тропонин С лишен ионов Са2+, весь тропониновый комплекс приобретает такую конформационную структуру, которая препятствует взаимодействию актина и миозина, и сокращения мышечного волокна не происходит (рис. 1.13, а). Иными словами, тропонин, лишенный ионов Са2+, блокирует взаимодействие актина и миозина.
| Рис. 1.11. Саркоплазматический ретикулум и перемещение ионов Са 2+ во время сокращения кардиомиоцита | 
|
|
|
|
|
| Рис. 1.12. Структура тонких (актиновых) и толстых (миозиновых) нитей саркомера. TC, TT и TI — тропонины. |
Во время деполяризации кардиомиоцита в саркоплазматическом ретикулуме происходит лавинообразное высвобождение большого количества ионов Са2+, быстро проникающих в цитоплазму, окружающую саркомеры. При этом ионы Са2+ связываются с тропонином. Это приводит к изменению пространственного расположения всего тропомиозинового комплекса: тропомиозин смещается таким образом, что активные участки тонких спиральных нитей актина становятся доступными для взаимодействия с миозином (рис. 1.13, б).

|
| Рис. 1.13. Функционирование тропомиозин–тропонинового комплекса во время расслабления (а) и сокращения (б) Красными кружочками обозначены Ca 2+; TC, TT и TI — тропонины C, T и I |
В результате такого взаимодействия образуются актомиозиновые мостики и актиновые нити скользят вдоль нитей миозина (рис. 1.14), что приводит к укорочению саркомера и всего мышечного волокна или развитию изометрического напряжения. Чем больше ионов Са2+ связалось с тропонином, тем больше образуется актомиозиновых мостиков и тем больше развиваемое мышцей напряжение, т.е. сила сокращения.

|
| Рис. 1.14. Взаимное расположение тонких и толстых нитей саркомера во время расслабления (а) и сокращения (б) |
Релаксация саркомера и мышечного волокна в целом происходит после того, как ионы Са2+ отщепляются от тропонина, который восстанавливает свою способность блокировать взаимодействие актина и миозина. Этот процесс обеспечивается активным обратным транспортом ионов Са2+ в саркоплазматический ретикулум и внеклеточную среду (рис. 1.15) за счет действия двух механизмов:
· кальциевой АТФ-азы мембраны саркоплазматического ретикулума и сарколеммы, которая в присутствии АТФ способствует активному транспорту Са2+ из клетки (рис. 1.15, а);
· Nа+-Са2+-обменного механизма клеточной мембраны, в результате которого Nа+ по электрохимическому градиенту перемещается внутрь клетки, а ион Са2+ — во внеклеточное пространство в обмен на ионы Nа+ (рис. 1.15, б).
|
|
|
Важно отметить, что функционирование Nа+-Са2+-обменного механизма тесно связано с концентрацией Nа+ внутри и вне клетки, которая достигается благодаря деятельности К+-Nа+-насоса (рис. 1.15, б). Именно этот механизм поддерживает высокие концентрации К+ внутри клетки, и Nа+ — вне клетки. Чем эффективнее работает К+-Nа+-насос, тем меньше внутриклеточная концентрация Nа+ и тем больше ионов Nа+ может проникнуть внутрь клетки по электрохимическому градиенту Nа+, а ионов Са2+ — из клетки в обмен на ионы Nа+.
Наоборот, при ингибировании К+-Nа+-насоса (увеличение ЧСС или действие сердечных гликозидов) снижается также интенсивность обменного механизма, и часть ионов Са2+ остается в клетке.
| Рис. 1.15. Два механизма удаления ионов Са 2+ из клетки. a — действие кальциевой АТФ-азы; б — функционирование Nа + -Са 2+ -обменного механизма, интенсивность которого связана с активностью К + -Nа + -насоса. Объяснение в тексте | 
|
 Запомните
1. В основе периодически сменяющих друг друга состояний мышечного сокращения и расслабления кардиомиоцитов лежит способность клеточных мембран обеспечивать различное движение ионов Са2+ из саркоплазматического ретикулума к миофибриллам (сокращение) и обратно (расслабление). 2. Содержание ионов Са2+ в кардиомиоцитах является главным фактором, регулирующим инотропное состояние сердца. Чем выше внутриклеточная концентрация Са2+, тем больше сократимость миокарда. 3. Внутриклеточная концентрация Са2+ регулируется многими факторами, в том числе активностью Са2+-АТФ-азы, К+-Nа+-насоса и Nа+-Са2+-обменного механизма. Запомните
1. В основе периодически сменяющих друг друга состояний мышечного сокращения и расслабления кардиомиоцитов лежит способность клеточных мембран обеспечивать различное движение ионов Са2+ из саркоплазматического ретикулума к миофибриллам (сокращение) и обратно (расслабление). 2. Содержание ионов Са2+ в кардиомиоцитах является главным фактором, регулирующим инотропное состояние сердца. Чем выше внутриклеточная концентрация Са2+, тем больше сократимость миокарда. 3. Внутриклеточная концентрация Са2+ регулируется многими факторами, в том числе активностью Са2+-АТФ-азы, К+-Nа+-насоса и Nа+-Са2+-обменного механизма.
|
Факторы, определяющие функцию сократимости. Важнейшей характеристикой функционирующей сердечной мышцы является зависимость между скоростью укорочения миокардиального волокна и развиваемым им напряжением (зависимость «сила–скорость»). Согласно данным Hill, скорость сокращения мышцы обратно пропорциональна силе (напряжению). Иными словами, чем больше нагрузка на мышцу, тем меньше скорость ее укорочения. Наоборот, при уменьшении нагрузки скорость сокращения увеличивается (рис. 1.16).
| Рис. 1.16. Кривая «сила–скорость», полученная на препарате изолированного миокарда (по E. Braunwald с соавт.,1976) | 
|
Функция сердечной мышцы, в том числе зависимость «сила–скорость», определяется двумя основными факторами:
1. Исходной длиной мышечного волокна, или конечно-диастолическим объемом желудочка.
2. Состоянием инотропизма (сократимости) миокарда, связанного с интенсивностью обменных процессов в сердечной мышце.
Зависимость силы сокращения от исходной длины мышечного волокна является решающим фактором, который определяет функцию сердечной мышцы (E. Braunwald с соавт.). Согласно закону Старлинга увеличение исходного конечно-диастолического объема желудочка в норме приводит к усилению сокращения желудочка, который становится способным развивать большее напряжение и преодолевать большую нагрузку (рис. 1.17). Существенно изменяется при этом и зависимость «сила–скорость» (рис. 1.18, а): увеличение исходной длины мышечного волокна сопровождается возрастанием максимально развиваемой силы сокращения, тогда как максимальная скорость сокращения не меняется.
|
|
|
Увеличение инотропизма сердечной мышцы, происходящее под действием возросшей симпатической активности или других факторов (см. ниже), ведет к увеличению как силы, так и максимальной скорости сокращения (рис. 1.18, б). Таким образом, инотропное состояние (сократимость) миокарда характеризуется способностью желудочка без увеличения конечно-диастолического объема (т.е. без «привлечения» механизма Франка – Старлинга) либо 1) выбрасывать в сосудистое русло больший объем крови; либо 2) выбрасывать тот же объем крови против большего сопротивления давления в магистральных сосудах. На рис. 1.17 видно, что при увеличении инотропизма (сократимости) кривая функции желудочка (т.е. взаимосвязи напряжения и конечно-диастолического объема) смещается вверх и влево. Это означает, что при тех же значениях конечно-диастолического объема желудочки в состоянии развивать большее напряжение. При угнетении инотропной функции (снижении сократимости) кривая функции желудочка смещается вправо и вниз. Причем при выраженном падении сократимости кривая идет вначале горизонтально, а затем опускается вниз. Иными словами, при данном состоянии инотропной функции растяжение сердечной мышцы (увеличение конечно-диастолического объема) сопровождается не увеличением, а снижением напряжения миокарда.
| Рис. 1.17. Зависимость силы сокращения от исходной длины мышечного волокна (конечно-диастолического объема) в контроле и при изменении инотропизма (по E. Braunwald с соавт.,1976) | 
|

|
| Рис. 1.18. Изменения кривой «сила–скорость» при увеличении исходной длины мышечного волокна (а) и изменении инотропизма (б) (по E. Braunwald с соавт.,1976) |
Следует еще раз обратить внимание, что состояние инотропизма оказывает влияние и на зависимость «сила — скорость» (рис. 1.18, б): при увеличении инотропизма возрастает не только сила, но и максимальная скорость сокращения, а при снижении сократимости сила и максимальная скорость уменьшаются.
| 1.1.3. Механическая работа сердца |

|

|
| Рис. 1.19. Деление сердечного цикла на систолу и диастолу |
Систола желудочков начинается с фазы асинхронного сокращения, которая определяется от начала комплекса QRS на ЭКГ до первых высокочастотных осцилляций I тона сердца на ФКГ (рис. 1.20). В течение этой фазы электрическое возбуждение быстро распространяется по миокарду желудочков и инициирует сокращение отдельных мышечных волокон. Их сокращение происходит асинхронно, поэтому внутрижелудочковое давление не возрастает, хотя форма желудочков существенно меняется. В конце этой фазы атриовентрикулярные клапаны неплотно смыкаются, но их напряжения и, соответственно, колебательных движений еще не наблюдается.

|
| Рис. 1.20. Изменения внутрисердечной гемодинамики во время фазы асинхронного сокращения желудочков (заштриховано красным цветом). Объяснение в тексте. Римскими цифрами обозначены тоны сердца |
Фаза изоволюмического сокращения (рис. 1.21) характеризуется быстрым и мощным сокращением миокарда желудочков, в результате чего в условиях полностью закрытых атриовентрикулярных и полулунных клапанов происходит резкое повышение внутрижелудочкового давления. Во время этой фазы возникает I тон сердца.

|
| Рис. 1.21. Изменения внутрисердечной гемодинамики во время фазы изоволюмического сокращения желудочков. Объяснение в тексте |
Как только давление в желудочках становится чуть больше чем в аорте и легочной артерии, открываются полулунные клапаны, и кровь поступает в магистральные сосуды — начинается фаза изгнания (рис. 1.22).

|
| Рис. 1.22. Изменения внутрисердечной гемодинамики во время фазы изгнания. Объяснение в тексте |
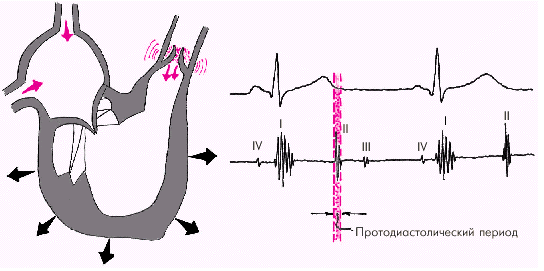
Диастола желудочков включает 5 фаз. Протодиастолический период (рис. 1.23) соответствует времени закрытия полулунных клапанов аорты и легочной артерии. В результате начавшегося расслабления миокарда желудочков давление в них падает чуть ниже давления в магистральных сосудах, что и является причиной закрытия клапанов. Во время этой фазы возникает II тон сердца.
|
| Рис. 1.23. Изменения внутрисердечной гемодинамики во время протодиастолического периода. Объяснение в тексте |
Во время фазы изоволюмического расслабления (рис. 1.24) продолжается активное расслабление желудочков, давление в них падает до уровня давления в предсердиях, после чего открываются атриовентрикулярные клапаны. Фаза изоволюмического расслабления в норме протекает в условиях герметически закрытых атриовентрикулярных и полулунных клапанов, и обьем желудочков не меняется.

|
| Рис. 1.24. Изменения внутрисердечной гемодинамики во время фазы изоволюмического расслабления желудочков. Объяснение в тексте |
Далее начинается продолжительный период наполнения желудочков, включающий три диастолические фазы. Во время фазы быстрого наполнения (рис. 1.25) кровь «пассивно», под действием градиента давлений поступает из предсердия в желудочки, причем в течение этой фазы происходит максимальное наполнение желудочков кровью. В конце этой фазы при определенных условиях (см. ниже) может возникнуть III дополнительный тон сердца.

|
| Рис. 1.25. Изменения внутрисердечной гемодинамики во время фазы быстрого наполнения желудочков. Объяснение в тексте |
В дальнейшем давление в предсердии и желудочке выравнивается, и наполнение последних замедляется. Это фаза медленного наполнения желудочков (рис. 1.26).

|
| Рис. 1.26. Изменения внутрисердечной гемодинамики во время фазы медленного наполнения желудочков. Объяснение в тексте |
Последняя диастолическая фаза (фаза систолы предсердий) характеризуется сокращением миокарда предсердий и активным изгнанием крови из предсердий в желудочки (риc. 1.27). В конце этой фазы створки атриовентрикулярных клапанов «всплывают» и неплотно смыкаются — желудочек вновь готов к очередному сокращению. При определенных условиях (см. ниже) во время этой фазы может возникнуть IV дополнительный тон сердца.

|
| Рис. 1.27. Изменения внутрисердечной гемодинамики во время систолы предсердий. Объяснение в тексте |
Давление в камерах сердца
Описанная последовательность сокращения и расслабления предсердий и желудочков обеспечивает достижение давлений в полостях сердца и магистральных сосудах, необходимых для нормального выброса крови в артериальную систему и адекватного наполнения камер сердца во время диастолы. Нормальные величины давления приведены в табл. 1.1.
Таблица 1.1
Нормальные величины давления в полостях сердца и магистральных сосудах в покое (мм рт. ст.)
| Максимальное систолическое давление | Конечно-диастолическое давление | Среднее давление | |
| Правое предсердие | – | – | 4–5 |
| Правый желудочек | 25–30 | 4–6 | – |
| Легочная артерия | 25–30 | 9–12 | – |
| Левое предсердие | – | – | 8–12 |
| Левый желудочек | 120–145 | 9–12 | – |
| Аорта | 120–145 | – |
Как видно из таблицы, в норме систолическое давление в ЛЖ и аорте значительно выше, чем в ПЖ и легочной артерии, тогда как величины диастолического давления в этих отделах отличаются в меньшей степени. Обращают на себя внимание также очень близкие значения конечно-диастолического давления в ЛЖ (КДДлж), среднего давления в ЛП и диастолического давления в легочной артерии.
Особое практическое значение имеет определение конечно-диастолического давления в ЛЖ, величина которого в покое и при физической нагрузке часто используется для характеристики функции желудочка. Повышение КДДлж ведет к росту давления в левом предсердии и легочных капиллярах. Если оно превышает 25–30 мм рт. ст., развивается альвеолярный отек легких. Таким образом, повышение КДДлж в большинстве случаев является весьма неблагоприятным прогностическим признаком. Снижение КДДлж нередко является указанием на наличие гиповолемии, сопровождающейся, как правило, уменьшением конечно-диастолического объема ЛЖ (кровопотеря, шок различного происхождения, длительный пароксизм суправентрикулярной или желудочковой тахикардии и т.п.).
Систолическая функция сердца
Основным показателем, характеризующим систолическую функцию сердца, является величина сердечного выброса. Сердечный выброс (или минутный объем крови — МО) — это количество крови, выбрасываемой желудочком в минуту. В норме эта величина варьирует в широких пределах: при необходимости сердечный выброс может увеличиваться в 3–5 раз по сравнению с покоем. Сердечный выброс рассчитывается следующим образом:
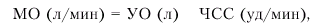
|
где МО — минутный объем крови (сердечный выброс), УО — ударный объем, ЧСС — частота сердечных сокращений.
Помимо величины сердечного выброса (МО), в клинике рассчитывают и другие показатели, часть из которых, по сути, являются производными МО и ЧСС:
· ударный объем (УО) — количество крови, выбрасываемой желудочком в магистральный сосуд при каждом сокращении:

|
где КДО — конечно-диастолический, а КСО — конечно-систолический объемы желудка;
· фракцию выброса (ФВ) — отношение УО к конечно-диастолическому объему желудочка (в %):

|
где ФВ — фракция выброса, УО — ударный объем; КДО — конечно-диастолический объем желудочка, КСО — конечно-систолический объем.
Фракция выброса (ФВ) — важнейший интегральный показатель систолической функции сердца, указывающий, какая часть конечно-диастолического объема крови (КДО) выбрасывается из желудочков во время их систолы.
· Сердечный индекс (СИ), который представляет собой отношение МО крови к площади поверхности тела (S, м2). СИ вычисляют по формуле:

|
При этом площадь поверхности тела (S) определяют по номограмме (рис. 1.28) или рассчитывают по специальной формуле:
· ударный индекс (УИ) — отношение ударного объема к площади поверхности тела (S, м2). УИ вычисляют по формуле:

|
где S — площадь поверхности тела (м2).
Для адекватной оценки систолической функции сердца необходимо учитывать также:
· конечно-диастолический объем желудочка (КДО);
· конечно-систолический объем желудочка (КСО);
· конечно-диастолическое давление в желудочке (КДД).
Чтобы правильно интерпретировать изменения сердечного выброса и другие гемодинамические показатели в каждом конкретном случае необходимо оценивать все факторы, влияющие на значения этого показателя.
| Рис. 1.28. Номограмма для определения площади поверхности тела по росту и массе тела | 
|
 Запомните
Степень укорочения сердечной мышцы и сердечный выброс определяются тремя основными факторами:
1. Величиной преднагрузки, измеряемой длиной мышечного волокна перед началом его сокращения или значениями конечно-диастолического объема желудочков (КДО). 2. Инотропным состоянием (сократимостью) миокарда, т.е. взаимоотношением между зависимостью «сила — скорость» и исходной длиной мышечного волокна. 3. Величиной постнагрузки, т.е. напряжением, которое должна развивать сердечная мышца во время сокращения. Запомните
Степень укорочения сердечной мышцы и сердечный выброс определяются тремя основными факторами:
1. Величиной преднагрузки, измеряемой длиной мышечного волокна перед началом его сокращения или значениями конечно-диастолического объема желудочков (КДО). 2. Инотропным состоянием (сократимостью) миокарда, т.е. взаимоотношением между зависимостью «сила — скорость» и исходной длиной мышечного волокна. 3. Величиной постнагрузки, т.е. напряжением, которое должна развивать сердечная мышца во время сокращения.
|
Величина преднагрузки. Уменьшение диастолического наполнения желудочков и КДО сопровождается падением сердечного выброса и УО. Наоборот, чем больше наполнение желудочков в диастолу (КДО), тем, согласно закону Старлинга, больше сила последующего сокращения и, соответственно, величина УО, МО и т.п. Правда, это последнее положение справедливо только до тех пор, пока сердечная мышца не окажется «перерастянутой», когда дальнейшее увеличение КДО приводит не к увеличению, а к уменьшению силы сокращения и УО.
Величина преднагрузки и КДО желудочков зависит от многих факторов, важнейшими из которых являются следующие (рис. 1.29).
1. Объем циркулирующей крови (ОЦК). Его уменьшение (при кровопотере, шоке, обезвоживании) закономерно приводит к снижению сердечного выброса, а увеличение (задержка натрия и жидкости в организме, не связанная с сердечной недостаточностью) — к повышению МО.
2. Приток крови к сердцу в большинстве случаев является решающим фактором, определяющим величину КДО желудочков. Увеличение притока крови к правым отделам сердца и, соответственно, минутного объема (МО) наблюдается: 1) при горизонтальном положении тела пациента; 2) при увеличении тонуса вен при мышечной работе, психоэмоциональном напряжении и т.п., а также 3) при увеличении «насосной» функции скелетных мышц (мышечная нагрузка). Уменьшение притока крови и сердечного выброса наблюдается: 1) при вертикальном положении тела пациента; 2) при увеличении внутригрудного давления (напряженный пневмоторакс, обструктивные заболевания легких, приступы малопродуктивного кашля и др.); 3) при повышении давления в полости перикарда (экссудативный или констриктивный перикардит, гидроперикард); 4) при резком падении тонуса вен (обморок, коллапс, прием нитроглицерина и т.п.); 5) при гиподинамии (за счет отсутствия «насосного» действия скелетных мышц).
3. Сокращение предсердий. При отсутствии синхронизированного с работой желудочков сокращения предсердий (мерцательная аритмия, трепетание предсердий) уменьшается диастолическое наполнение желудочков и, соответственно, сердечный выброс.
4. Общая продолжительность диастолы. Тахикардия сопровождается значительным уменьшением продолжительности диастолы и, соответственно, величины преднагрузки. При синусовой брадикардии, наоборот, наблюдается увеличение наполнения желудочков.
Инотропное состояние (сократимость) миокарда во многих случаях является главным фактором, определяющим величину сердечного выброса. Сократимость миокарда в свою очередь определяется следующими факторами.
1. Активностью симпатической нервной системы.
2. Частотой сердечных сокращений (ЧСС).
3. Наличием у больного некоторых патологических состояний, угнетающих сократимость миокарда (гипоксемии, ацидоза, гиперкапнии, ишемии сердечной мышцы, воспаления миокарда и т.п.).
|
|
|


