 |
Исследование других органов 3 глава
|
|
|
|
3. Эндотелиальный гиперполяризующий фактор (ЭГПФ), также вырабатываемый эндотелиальными клетками, вызывает гиперполяризацию мембран гладкомышечных клеток (подробнее — см. главу 3) и снижает их чувствительность к разнообразным констрикторным влияниям. Выделение ЭГПФ вызывает открытие калиевых каналов гладкомышечных клеток, что сопровождается расслаблением сосудов. Характерно, что в отличие от оксида азота, ЭГПФ выделяется эндотелием не постоянно, а только под действием некоторых стимулов (ацетилхолин, брадикинин, тромбин, гистамин, субстанция Р, АДФ, АТФ и др.).
| Рис. 1.40. Синтез тромбоксана А 2 и простациклина | 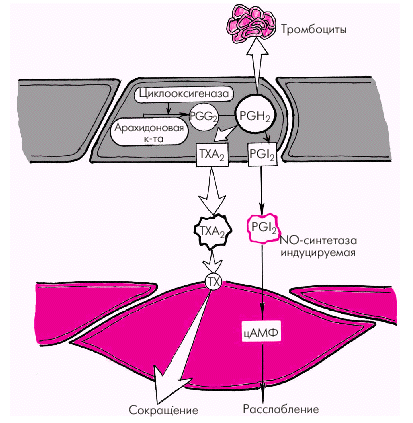
|
Вазоконстрикторные факторы. К числу важнейших эндотелийзависимых вазоконстрикторных субстанций, повышающих сосудистый тонус, агрегацию тромбоцитов и свертываемость крови, относятся эндотелин-1 (ЕТ1), тромбоксан А2, простагландин PGH2, ангиотензин II (АII) и др.
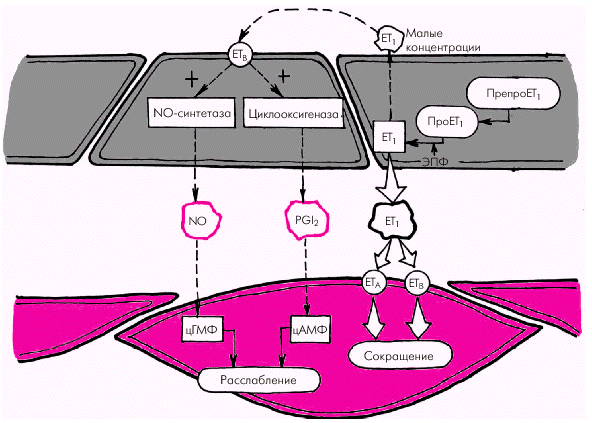
1. Эндотелин-1 (ЕТ1) является наиболее мощным из всех известных вазоконстрикторов. Процесс образования ЕТ1 включает несколько стадий (рис. 1.41). Вначале из предшественника эндотелинов (препроэндотелина) образуется так называемый «большой эндотелин» (проэндотелин), который, в свою очередь, под действием эндотелин-превращающего фермента (ЭПФ) трансформируется в активный полипептид, состоящий из 21 аминокислоты, — эндотелин-1 (ЕТ1). Связываясь со специфическими рецепторами клеточных мембран (ЕТА и ЕТВ), эндотелин-1 повышает внутриклеточную концентрацию ионов Са2+, что ведет к усилению сокращения гладких мышц сосудистой стенки. В физиологических условиях концентрация ЕТ1 в плазме очень мала, что связано, прежде всего, с ингибированием синтеза эндотелина-1 описанными выше вазодилатирующими субстанциями (оксидом азота и простациклином РGI2). Малые количества ЕТ1 активируют образование эндотелиальными клетками этих факторов расслабления (рис. 1.41, левая часть). В более высоких концентрациях ЕТ1 стимулирует рецепторы ЕТА и ЕТВ гладкомышечных клеток, вызывая стойкую и выраженную вазоконстрикцию (рис. 1.41, правая часть). Образование ЕТ1 усиливается при воздействии на эндотелиальные клетки тромбина, вазопрессина, интерлейкина-1, ангиотензина II и других веществ, а также при возникновении гипоксии, повышении АД, ускорении кровотока и т.п.
|
|
|
|
| Рис. 1.41. Синтез эндотелина. Обозначения те же, что и на рис. 1.38 |
2. Тромбоксан А2 и простагландин РGН2 относятся к числу активных эндотелиальных вазоконстрикторов, обладающих также свойством активировать агрегацию тромбоцитов и тромбообразование. Являясь продуктами метаболизма арахидоновой кислоты, они присутствуют во многих тканях организма, в том числе в сосудистом эндотелии (см. рис. 1.38 и 1.40).
3. Тканевой ангиотензин II (АII) также относится к числу мощных вазоконстрикторов, образующихся в эндотелии различных сосудистых областей (см. рис. 1.38). Он образуется из неактивного ангиотензина I (АI) под действием тканевого ангиотензин-превращающего фермента (АПФ). Этот фермент присутствует в эндотелиальных клетках, что обеспечивает образование АII непосредственно на поверхности эндотелия. Взаимодействуя со специфическими ангиотензиновыми рецепторами (АТ1) гладкомышечных клеток, он также увеличивает внутриклеточную концентрацию Са2+, усиливая сокращение гладких мышц сосудистой стенки.
В физиологических условиях существует оптимальное соотношение выработки эндотелиальных вазодилатирующих и вазоконстрикторных субстанций, которое полностью соответствует метаболическим потребностям органа и основным параметрам центральной гемодинамики. При действии на сосудистый эндотелий различных повреждающих факторов (гипоксии, чрезмерной концентрации катехоламинов, ангиотензина II, серотонина, высокого уровня АД, ускорения кровотока и др.) начинают преобладать вазоконстрикторные механизмы регуляции сосудистого тонуса и развивается так называемая дисфункция эндотелия. Последняя характеризуется повышением тонуса сосудистой стенки, ускорением агрегации тромбоцитов, процессов пристеночного тромбообразования и т.п.
|
|
|
 Запомните
1. Основными эндотелийзависимыми вазодилатирующими факторами, оказывающими влияние на сосудистый тонус и агрегацию тромбоцитов, являются: · эндотелиальный расслабляющий фактор (оксид азота NO); · простациклин PGI2; · эндотелиальный гиперполяризующий фактор (ЭГПФ). 2. К числу важнейших эндотелийзависимых вазоконстрикторных субстанций, повышающих сосудистый тонус, агрегацию тромбоцитов и свертываемость крови, относятся: · эндотелин-1 (ЕТ1); · тромбоксан А2; · простагландин РGН2; · ангиотензин II (АII). 3. Дисфункция эндотелия, возникающая под действием различных повреждающих факторов (гипоксии, чрезмерной концентрации катехоламинов, ангиотензина II, серотонина, высокого уровня АД, ускорения кровотока и др.), характеризуется преобладанием вазоконстрикторных эндотелийзависимых влияний и закономерно сопровождается повышением тонуса сосудистой стенки, ускорением агрегации тромбоцитов и процессов пристеночного тромбообразования. Запомните
1. Основными эндотелийзависимыми вазодилатирующими факторами, оказывающими влияние на сосудистый тонус и агрегацию тромбоцитов, являются: · эндотелиальный расслабляющий фактор (оксид азота NO); · простациклин PGI2; · эндотелиальный гиперполяризующий фактор (ЭГПФ). 2. К числу важнейших эндотелийзависимых вазоконстрикторных субстанций, повышающих сосудистый тонус, агрегацию тромбоцитов и свертываемость крови, относятся: · эндотелин-1 (ЕТ1); · тромбоксан А2; · простагландин РGН2; · ангиотензин II (АII). 3. Дисфункция эндотелия, возникающая под действием различных повреждающих факторов (гипоксии, чрезмерной концентрации катехоламинов, ангиотензина II, серотонина, высокого уровня АД, ускорения кровотока и др.), характеризуется преобладанием вазоконстрикторных эндотелийзависимых влияний и закономерно сопровождается повышением тонуса сосудистой стенки, ускорением агрегации тромбоцитов и процессов пристеночного тромбообразования.
|
Продукты метаболизма
В интенсивно работающем органе под действием продуктов метаболизма (ионов Н+, аденозина, АТФ, АДФ, АМФ, СО2, молочной кислоты и др.) и биологически активных веществ (брадикинина, гистамина и др.) также происходит снижение тонуса артериол и прекапиллярных сфинктеров и увеличивается, таким образом, число функционирующих капилляров. Наоборот, при снижении метаболизма эти эффекты уменьшаются и происходит адекватное ограничение органного кровотока. Одним из таких продуктов метаболизма является аденозин — вещество, играющее важную роль в распаде макроэргических фосфатных соединений. Доказано, что усиление метаболизма органа (например, сердца) закономерно сопровождается ускоренным дефосфорилированием АМФ с образованием аденозина, который, поступая в межклеточное пространство, вызывает значительное расширение артериол и увеличение органного кровотока.
|
|
|
Центральные механизмы регуляции
Центральные механизмы регуляции сосудистого тонуса включают в себя афферентное (сенсорное), центральное и эфферентное звенья.
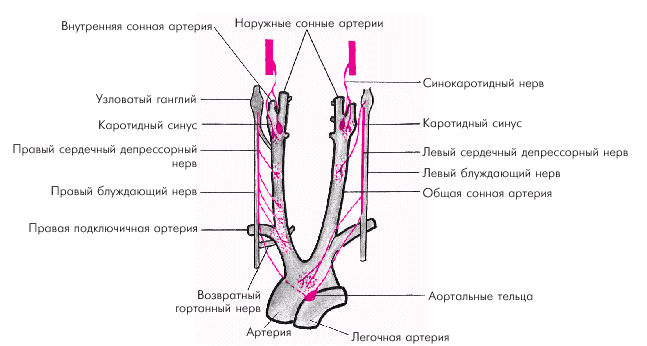
Афферентное звено представлено многочисленными баро- и хеморецепторами, расположенными в нескольких рефлексогенных зонах сосудистой системы (аорта, синокаротидная зона, сосуды легких и др.) (рис. 1.42). Барорецепторы реагируют на степень и скорость растяжения стенки сосудов (или полостей сердца). При повышении АД или наполнения камер сердца барорецепторы отвечают усилением афферентной импульсации, при снижении АД — ее уменьшением. Хеморецепторы дуги аорты, синокаротидной зоны и других рефлексогенных зон (сердце, почки, органы пищеварения) аналогично реагируют на изменение в крови концентрации О2, СО2, ионов Н+. Чувствительные волокна от баро- и хеморецепторов дуги аорты и каротидного синуса проходят в составе синокаротидного нерва, ветвей языкоглоточного нерва и депрессорного нерва (рис. 1.42).
Центральное звено регуляции сосудистого тонуса — вазомоторный центр — представлено различными функционально связанными между собой нервными структурами, расположенными в продолговатом, спинном мозге, гипоталамусе, коре больших полушарий.
Эфферентное звено включает нервные и гуморальные механизмы регуляции сосудистого тонуса. В зависимости от скорости развития циркуляторных эффектов различают: 1) механизмы быстрого кратковременного действия; 2) механизмы промежуточного действия; 3) механизмы длительного действия.
|
| Рис. 1.42. Баро- и хеморецепторы аорты и каротидного синуса |
К механизмам быстрого кратковременного действия относятся нервные рефелекторные реакции, возникающие при раздражении баро- и хеморецепторов описанных рефлексогенных зон, а также при ишемии ЦНС. Эти реакции развиваются в течение нескольких секунд и реализуются через рефлекторные изменения активности симпатической и парасимпатической нервных систем, а также через изменение концентрации гуморальных веществ — адреналина и норадреналина. Раздражение барорецепторов аорты и каротидного синуса (например, при повышении АД или механическом воздействии на эти зоны) закономерно приводит к снижению симпатических (вазоконстрикторных) и усилению парасимпатических (депрессорных) влияний. В результате снижается сосудистый тонус, а также частота и сила сокращения сердца, что способствует нормализации АД. Наоборот, при падении АД (например, при кровопотере) импульсация с барорецепторов уменьшается и начинают преобладать симпатические влияния — увеличение ЧСС, сердечного выброса и сосудистого тонуса.
|
|
|
Аналогичным образом возникает ответ на раздражение В-рецепторов растяжения предсердий и рецепторов растяжения желудочков, например, при быстром увеличении их наполнения. В результате снижения тонуса симпатических и повышения активности парасимпатических нервов развивается брадикардия и вазодилатация.
Возбуждение хеморецепторов дуги аорты и каротидного синуса при снижении напряжения О2, повышении напряжения СО2 или увеличении концентрации ионов Н+ в крови приводит к сужению резистивных сосудов и подъему АД. К такому же эффекту приводит рефлекторная реакция на ишемию ЦНС, например, при недостаточном кровоснабжении головного мозга, гипоксемии или резком падении АД. Повышение концентрации Н+ и СО2 сопровождается раздражением хеморецепторов ствола мозга и значительным подъемом АД.
Симпатической нервной системе принадлежит ведущая роль в регуляции тонуса периферических сосудов. Влияние адреналина и норадреналина на тонус различных сосудистых областей зависит от концентрации этих веществ в крови и от соотношения в разных сосудах a- и b-адренорецепторов (рис. 1.43). Как известно, возбуждение a-рецепторов сопровождается сокращением гладких мышц, а возбуждение b-рецепторов — их расслаблением.
Норадреналин воздействует преимущественно на a-адренорецепторы, вызывая в экстремальных условиях увеличение сосудистого тонуса, системного периферического сопротивления и АД. Адреналин взаимодействует как с a-, так и с b-адренорецепторами. В физиологических концентрациях он возбуждает преимущественно b-рецепторы, вызывая расслабление гладкой мускулатуры сосудов, особенно тех из них, в которых преобладают b-адренорецепторы (скелетные мышцы, мозг, сердце). Одновременно адреналин повышает УО и ЧСС, в результате чего в обычных физиологических условиях (в покое, при умеренной физической нагрузке, эмоциональном возбуждении) уровень системного АД под действием адреналина существенно не меняется. В этих условиях главный циркуляторный эффект адреналина заключается в перераспределении сердечного выброса и обеспечении интенсивного кровотока в скелетных мышцах, мозге и сердце.
|
|
|
| Рис. 1.43. Влияние норадреналина (На) и адреналина (А) на a- и b-рецепторы сосудов и различные циркуляторные эффекты | 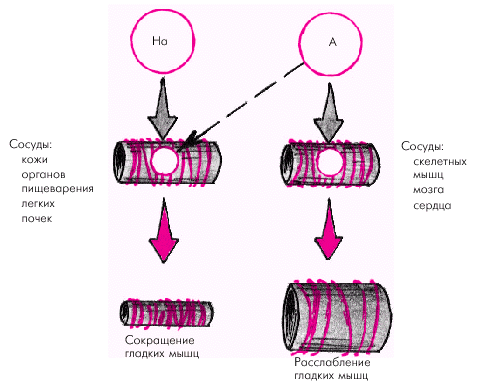
|
В экстремальных ситуациях (сильный эмоциональный стресс, острое кровотечение и т.п.), когда концентрация адреналина в крови повышается в десятки раз, может проявляться его взаимодействие с a-адренорецепторами сосудов и преобладать сосудосуживающие реакции (особенно в коже, органах пищеварения и легких, в которых имеется большое количество a-рецепторов).
Главным регуляторным механизмом промежуточного действия является почечная ренин-ангиотензиновая система (РАС). Ее активация, наступающая при снижении кровоснабжения почек любого генеза (падение АД, сужение почечных сосудов и т.п.), сопровождается выделением ренина, который способствует превращению ангиотензиногена в ангиотензин I (рис. 1.44). Последний под действием АПФ превращается в ангиотензин II, обладающий мощным вазоконстрикторным действием. Кроме того, ангиотензин II возбуждает центральные и периферические симпатические структуры. Все это приводит к росту периферического сопротивления и повышению (нормализации) АД. Следует помнить, что существует альтернативный путь трансформации АI в АII, без участия АПФ (см. ниже).
| Рис. 1.44. Схема активации ренин-ангиотензиновой системы при снижении артериального давления. АПФ — ангиотензин-превращающий фермент | 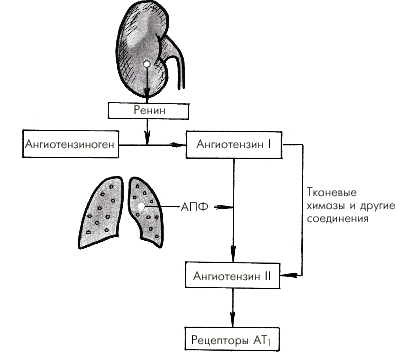
|
К регуляторным механизмам длительного действия относят почечные системы контроля за объемом жидкости, системы альдостерона и вазопрессина, механизмы действия которых разбираются в последующих главах.
| 1.2.4. Особенности регуляции коронарного кровообращения |

|
 Запомните
В норме величина коронарного кровотока полностью соответствует постоянно изменяющейся потребности миокарда в кислороде с учетом максимально возможной экстракции сердечной мышцей кислорода из артериальной крови, достигающей 70–80%. Запомните
В норме величина коронарного кровотока полностью соответствует постоянно изменяющейся потребности миокарда в кислороде с учетом максимально возможной экстракции сердечной мышцей кислорода из артериальной крови, достигающей 70–80%.
|
Величина коронарного кровотока регулируется прежде всего уровнем метаболизма сердечной мышцы и, соответственно, потребностью миокарда в кислороде. Последняя, как известно, определяется тремя основными факторами.
1. Величиной внутримиокардиального напряжения, т.е. силой, приходящейся на единицу поверхности поперечного сечения желудочков в момент их сокращения.
2. Частотой сердечных сокращений (ЧСС).
3. Сократимостью сердечной мышцы (уровнем ее инотропизма).
Напряжение миокарда. Согласно уравнению Лапласа, напряжение миокарда (F) прямо пропорционально внутрижелудочковому давлению (Р) и радиусу полости желудочка (r) и обратно пропорционально толщине его стенок (h):
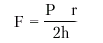
|
Максимальное напряжение стенки желудочка возникает в период систолы, когда давление в желудочке резко возрастает и достигает уровня давления в аорте. Следовательно, наибольшее напряжение, развиваемое стенкой желудочка, в первую очередь, определяется величиной систолического АД (САД). Исключение составляют случаи обструкции выносящего тракта ЛЖ (стеноз устья аорты, ГКМП и др.), когда внутрижелудочковое давление становится существенно выше давления в аорте и последнее не может полностью охарактеризовать величину напряжения миокарда желудочка.
|
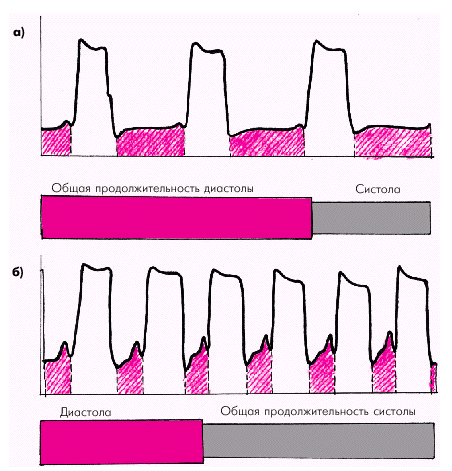
| Рис. 1.45. Общая продолжительность диастолы при нормальной ЧСС (а) и ее изменение при тахикардии (б). Показаны кривые внутрижелудочкового давления; красной штриховкой обозначена диастола |
Во время диастолы напряжение стенки желудочка определяется преимущественно уровнем преднагрузки и зависит от величины КДД и КДО. Чем больше диастолические размеры полости ЛЖ (дилатация, аневризма) или выше КДД, тем больше напряжение стенки желудочка и выше потребность миокарда в кислороде.
Следует отметить, что напряжение, развиваемое стенкой ПЖ, оказывается значительно меньшим, чем ЛЖ, что связано главным образом с меньшей величиной давления в ЛА и меньшими размерами ПЖ.
Частота сердечных сокращений (ЧСС) является важным независимым фактором, влияющим на потребление миокардом кислорода. Увеличение ЧСС сопровождается по понятным причинам изменением временных соотношений между систолой и диастолой (рис. 1.45). При этом существенно увеличивается «чистое» рабочее время желудочков, т.е. общая продолжительность всех систол за единицу времени. В связи с этим потребление миокардом кислорода возрастает примерно пропорционально корню квадратному из ЧСС.
Следует заметить, что в клинике для количественной характеристики потребления миокардом кислорода давно используется показатель так называемого «двойного произведения» (ДП), который рассчитывается следующим образом:
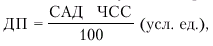
|
где САД — систолическое АД.
Чем выше показатель «двойного произведения» в покое или при нагрузке, тем большее напряжение развивает сердечная мышца и тем более высокой оказывается потребность миокарда в кислороде. Она становится еще более высокой, если в результате патологических процессов оказываются увеличенными размеры ЛЖ (дилатация, аневризма).
Сократимость. Уровень инотропизма сердечной мышцы (см. выше) оказывает существенное влияние на потребность миокарда в кислороде. Правда, имеется сложность прямой количественной оценки сократимости миокарда у человека.
Факторы, влияющие на величину коронарного кровотока
Величина коронарного кровотока зависит от двух основных факторов:
1. Перфузионного давления, т.е. давления, которое обеспечивает движение крови по коронарным сосудам.
2. Общего сопротивления коронарных сосудов.
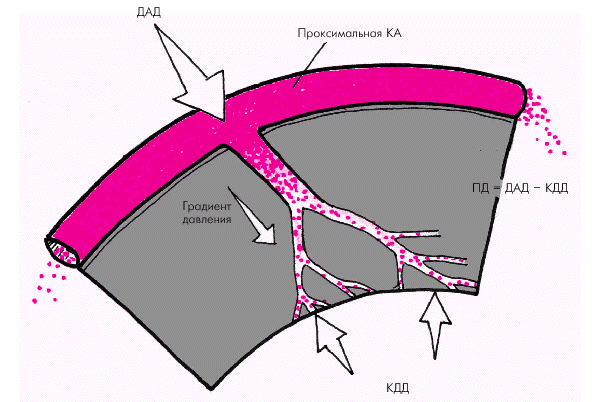
Перфузионное давление определяется разностью давлений на входе и выходе системы венечных сосудов (рис. 1.46). Входным давлением для коронарного кровообращения является диастолическое давление крови в аорте, поскольку во время систолы происходит сжатие сосудов окружающим миокардом, и его перфузия осуществляется в основном во время диастолы (см. ниже). Чем выше диастолическое АД, тем (при прочих равных условиях) больше перфузионное давление и выше коронарный кровоток. Выходным давлением для коронарного кровотока является величина внутримиокардиального напряжения, определяющего степень сжатия сети микроциркуляции. При известных допущениях внутримиокардиальное напряжение, которое развивает желудочек во время диастолы, может быть приравнено к внутрижелудочковому давлению, в частности, к конечно-диастолическому давлению в желудочке (КДД). Из сказанного следует, что чем выше уровень ДАД и ниже внутрижелудочковое давление (например, КДД), тем больше перфузионное давление во время диастолы и выше поток крови в коронарных сосудах.
|
| Рис. 1.46. Факторы, определяющие величину перфузионного давления (ПД) в коронарной системе |
В патологических условиях при снижении ДАД ниже 60–70 мм рт. ст. (недостаточность клапана аорты, коллапс и др.) перфузионное давление падает, и коронарный кровоток может существенно уменьшиться. С другой стороны, любое повышение КДД и/или КДО ЛЖ, вызванное увеличением преднагрузки, дилатацией полости желудочка или развитием выраженной гипертрофии миокарда ЛЖ, закономерно сопровождается снижением перфузионного давления и ухудшением коронарного кровотока. Такой же эффект наблюдается при увеличении сократимости миокарда, а также при увеличении ЧСС.
Влияние высокого интрамиокардиального (или внутрижелудочкового) давления на величину коронарного кровотока хорошо иллюстрируется почти полным прекращением перфузии миокарда во время систолы желудочков (рис. 1.47). При этом силы, сжимающие субэндокардиальные сосуды, по понятным причинам существенно выше сил, которые сдавливают субэпикардиальную микроциркуляторную сеть. Поэтому в отличие от субэндокардиального кровотока ЛЖ перфузия субэпикардиальных отделов миокарда ЛЖ во время систолы полностью не прекращается. Это означает, что при различных патологических состояниях, ограничивающих коронарный кровоток, наиболее уязвимой для возникновения ишемии всегда оказывается субэндокардиальная микроциркуляторная сеть ЛЖ.
| Рис. 1.47. Величина коронарного кровотока в систолу (S) и диастолу (D) Вверху — давление в аорте, внизу — объем коронарного кровотока в субэндокардиальных отделах | 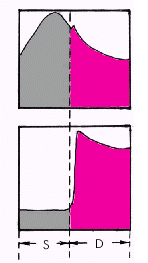
|
Поскольку внутримиокардиальное напряжение стенки ПЖ существенно ниже, чем левого, кровоток в бассейне ПКА меньше подвержен влиянию этого напряжения во время систолы ПЖ и изменяется, главным образом, в соответствии с перепадами давления в аорте.
Следует подчеркнуть, что в физиологических условиях, независимо от возможных колебаний уровня давления в аорте, изменяющихся величин преднагрузки или других гемодинамических параметров, уровень перфузионного давления и величина коронарного кровотока всегда соответствуют потребности миокарда в кислороде, что обеспечивается нормальным функционированием системы нейрогуморальной регуляции тонуса коронарных артерий (см. ниже).
Сопротивление коронарных сосудов. Различают несколько функциональных компонентов, из которых складывается общее сопротивление коронарных сосудов (рис. 1.48).
В норме крупные эпикардиальные КА (R1) вносят относительно малый вклад в общее сопротивление коронарной системы. Определенное значение, по-видимому, имеет «шероховатость» стенок крупных КА, особенности их анатомического строения. Повышение гематокрита (Ht) и/или вязкости крови в целом увеличивает общее сопротивление коронарных сосудов, а их уменьшение способствует снижению сопротивления. Иная ситуация складывается в условиях патологии, например, при формировании атеросклеротических бляшек или внутрисосудистых тромбов, сужающих просвет крупной КА. В этих случаях резко повышается сопротивление коронарной системы, что существенно ограничивает коронарный кровоток.
| Рис. 1.48. Сосудистое сопротивление коронарной системы | 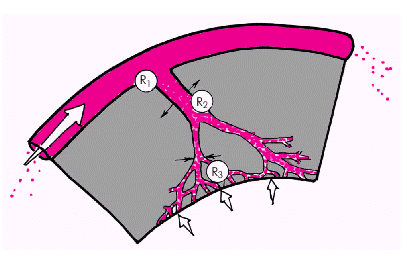
|
Наибольшее влияние на величину коронарного кровотока оказывает динамическое сопротивление резистивных КА (артериол) (R2). Именно на уровне артериол происходит ауторегуляторное изменение тонуса КА (их расширение или сужение), что в физиологических условиях обеспечивает адекватность коронарного кровотока постоянно меняющимся потребностям миокарда в кислороде.
Наконец, третьим важнейшим компонентом общего сопротивления коронарного русла является величина внутримиокардиального напряжения (или внутрижелудочкового давления) (R3), увеличение которого, как было показано выше, ведет к сдавлению микроциркуляторного русла, росту общего сопротивления коронарной системы и ограничению кровотока.
Механизмы регуляции коронарного кровотока
К числу основных механизмов регуляции тонуса КА относятся:
1. Местные механизмы саморегуляции, включая эндотелиальные и метаболические факторы.
2. Нервные механизмы регуляции.
Местная регуляция коронарного кровотока. В нормальных условиях основное (но не единственное) влияние на сопротивление коронарных сосудов оказывает уровень метаболизма миокарда. Любое усиление обменных процессов, обусловленное увеличением пост- или преднагрузки, ЧСС, сократимости миокарда или уменьшением перфузионного давления (см. выше), сопровождается высвобождением из клеток миокарда и сосудистого эндотелия ряда веществ, обладающих мощным вазодилатирующим действием. Расширение резистивных КА (артериол) приводит к снижению сопротивления коронарного русла и увеличению коронарного кровообращения.
Выше были описаны основные вазодилатирующие субстанции, участвующие в регуляции местного кровотока:
· эндотелиальный расслабляющий фактор (оксид азота, NO);
· простациклин PGI2;
· эндотелиальный гиперполяризующий фактор (ЭГПФ);
· аденозин;
· брадикинин и др.
Помимо описанных факторов, вызывающих расширение венечных сосудов при увеличении работы сердца и повышении потребности миокарда в кислороде, в метаболической регуляции коронарного кровотока, по-видимому, определенную роль играет непосредственное снижение рО2, повышение рСО2, ионов К+ и уменьшение рН, хотя значение этих факторов регуляции коронарного кровотока полностью не изучено.
В норме, как известно, существует сбалансированность выработки вазодилатирующих и вазоконстрикторных субстанций, которая обеспечивает полное соответствие коронарного кровотока метаболическим потребностям сердечной мышцы. Возникающая под действием различных повреждающих факторов дисфункция эндотелия является основной причиной нарушений регуляции коронарного кровотока, повышения тонуса КА, ускорения агрегации тромбоцитов и процессов пристеночного тромбообразования.
Нервная регуляция коронарного кровотока. Поскольку гладкомышечные клетки коронарных сосудов обладают как a- и b-адренергическими, так и М-холинергическими рецепторами, нервная регуляция коронарного кровотока осуществляется обоими отделами вегетативной нервной системы. В целом стимуляция a-адренорецепторов вызывает сужение КА, а b2–адренорецепторов и М-холинорецепторов — их расширение (см. табл. 1.2 и 1.3). Однако оценивая конечные эффекты активации симпатической и парасимпатической нервных систем, следует учитывать не только прямое влияние такой активации на гладкомышечные клетки венечных сосудов, но и опосредованное их действие на уровень обменных процессов в миокарде, ЧСС, сократимость сердечной мышцы и т.д.
Например, в физиологических условиях стимуляция симпатических эфферентных волокон вызывает опосредованное a-адренорецепторами прямое сосудосуживающее действие, которое сменяется затем стабильной и выраженной метаболической дилатацией КА. Последняя обусловлена стимуляцией a1- и b1-адренорецепторов рабочего миокарда и, соответственно, увеличением обменных процессов и потребности сердца в кислороде, вызывающем метаболическое расслабление гладкомышечных клеток коронарных сосудов под действием аденозина, оксида азота, простациклина и других факторов. Естественно, в патологических условиях вазодилатационный эффект активации САС по разным причинам может быть существенно ослаблен. Кроме того, стимуляция a1-адренорецепторов может вызвать выраженный спазм крупных КА.
Стимуляция парасимпатических эфферентных волокон вызывает прямое сосудорасширяющее действие, опосредованное М-холинергическими рецепторами гладкомышечных клеток коронарных сосудов. Кроме того, медиатор парасимпатической нервной системы ацетилхолин, воздействуя на пресинаптические М-рецепторы, расположенные в окончаниях симпатических нервов, ингибирует освобождение норадреналина из симпатических нервных окончаний, ограничивая тем самым эффекты симпатической активации. Следует также учитывать, что активация парасимпатической нервной системы сопровождается снижением инотропизма сердечной мышцы, уменьшением ЧСС, что способствует восстановлению баланса между потребностью миокарда в кислороде и реальной величиной коронарного кровотока.
Таким образом, каждое звено регуляции коронарного кровотока должно рассматриваться как сложный каскад взаимосвязанных эффектов, направленных не только на прямое изменение тонуса КА, но и воздействующих на другие факторы, определяющие соотношение коронарного кровотока и потребности миокарда в кислороде.
| Глава 2. Сердечная недостаточность |

|
| 2.1. Этиология |

|
|
|
|


