 |
Структура мышечного волокна и его сокращение.
|
|
|
|
Мышечное сокращение в живой системе это механохимический процесс. Современная наука считает его самой совершенной формой биологической подвижности. Сокращение мышечного волокна биологические объекты «разработали» как способ перемещения в пространстве (что значительно расширило их жизненные возможности).
Мышечному сокращению предшествует фаза напряжения, которая является результатом работы, осуществляемой путем преобразования энергии химической в механическую напрямую и с хорошим КПД (30-50 %). Накопление потенциальной энергии в фазе напряжения приводит мышцу в состояние возможного, но еще не реализованного сокращения.
У животных и человека имеются (а человек считает, что уже и неплохо изучены) два основных типа мышц: поперечнополосатые и гладкие. Поперечнополосатые мышцы или скелетные прикреплены к костям (кроме поперечнополосатых волокон сердечной мышцы, отличающихся от скелетных мышц и по составу). Гладкие мышцы поддерживают ткани внутренних органов и кожу и образуют мускулатуру стенок кровеносных сосудов, а также кишечника.
В биохимии спорта изучают скелетные мышцы, «конкретно отвечающие» за спортивный результат.
Мышца (как макро образование, принадлежащее макро объекту) состоит из отдельных мышечных волокон (микро образований). В мышце их тысячи, соответственно, мышечное усилие – величина интегральная, суммирующая сокращения множества отдельных волокон. Различают мышечные волокна трех типов: белые быстросокращающиеся, промежуточные и красные медленно сокращающиеся. Типы волокон различаются механизмом их энергетического обеспечения и управляются разными мотонейронами. Типы мышц различаются соотношением типов волокон.
|
|
|
Отдельное мышечное волокно – нитевидное бесклеточное образование – симпласт. На клетку симпласт «не похож»: имеет сильно вытянутую форму в длину от 0,1 до 2-3 см, в портняжной мышце до 12 см, и толщину – от 0,01 до 0,2 мм. Симпласт окружен оболочкой – сарколеммой, к поверхности которой подходят окончания нескольких двигательных нервов. Сарколемма – это двухслойная липопротеидная мембрана (толщиной 10 нм), укрепленная сетью коллагеновых волокон. При расслаблении после сокращения они возвращают симпласт в исходную форму (рис. 4).

Рис. 4. Отдельное мышечное волокно.
На наружной поверхности сарколеммы-мембраны всегда поддерживается электрический мембранный потенциал, даже в состоянии покоя он равен 90-100 мВ. Наличие потенциала является необходимым условием для управления мышечным волокном (как аккумулятор для авто). Потенциал создается за счет активного (значит с затратами энергии – АТФ) переноса веществ через мембрану и ее избирательной проницаемости (по принципу – «кого хочу – того и впущу, или выпущу»). Поэтому внутри симпласта некоторые ионы и молекулы накапливаются в большей концентрации, чем снаружи.
Сарколемма хорошо проницаема для ионов К+ – они накапливаются внутри, а наружу выводятся ионы Nа+. Соответственно, концентрация ионов Nа+ в межклеточной жидкости больше, чем концентрация ионов К+ внутри симпласта. Смещение pH в кислую сторону (при образовании молочной кислоты, например) увеличивает проницаемость сарколеммы для высокомолекулярных веществ (жирных кислот, белков, полисахаридов), которые в обычном состоянии через нее не проходят. Легко проходят (диффундируют) через мембрану низкомолекулярные вещества (глюкоза, молочная и пировиноградная кислоты, кетоновые тела, аминокислоты, короткие пептиды).
Внутреннее содержимое симпласта – саркоплазма – этоколлоидная белковая структура (по консистенции напоминает желе). Во взвешенном состоянии в ней находятся включения гликогена, жировые капли, в нее «встроены» различные субклеточные частицы: ядра, митохондрии, миофибриллы, рибосомы и другие.
|
|
|
Сократительный «механизм» внутри симпласта – миофибриллы. Это тонкие(Ø 1 – 2 мкм) мышечные нити, длинные – почти равны длине мышечного волокна. Установлено, что в симпластах нетренированных мышц миофибриллы располагаются не упорядоченно, вдоль симпласта, но с разбросом и отклонениями, а в тренированных – миофибириллы ориентированы по продольной оси и еще сгруппированы в пучки как в канатах. (При прядении искусственных и синтетических волокон макромолекулы полимера сначала располагаются не строго вдоль волокна и их, как спортсменов, «упорно тренируют» – ориентируют правильно – по оси волокон, путем многократной перемотки: смотри длиннющие цеха на ЗИВе и «Химволокно»).
В световой микроскоп можно наблюдать, что миофибриллы действительно «поперечно полосатые». В них чередуются светлые и темные участки – диски. Темные диски А (анизотропные) белка содержат больше, чем светлые диски I (изотропные). Светлые диски пересечены мембранами Z (телофрагмами) и участок миофибриллы между двумя Z -мембранами называется саркомером. Миофибрилла состоит из 1000 – 1200 саркомеров (рис. 5).
Сокращение мышечного волокна в целом складывается из сокращений единичных саркомеров. Сокращаясь каждый отдельно,саркомерывсе вместе создают интегральное усилие и выполняют механическую работу по сокращению мышцы.
Длина саркомера меняется от 1,8 мкм в покое до 1,5 мкм при умеренном и до 1 мкм при полном сокращении. Диски саркомеров, темных и светлых, заключают в себе протофибриллы (миофиламенты) – белковые нитевидные структуры. Они встречаются двух типов: толстые (Ø – 11 – 14 нм, длиной – 1500 нм) и тонкие (Ø – 4 – 6 нм, длиной – 1000 нм).
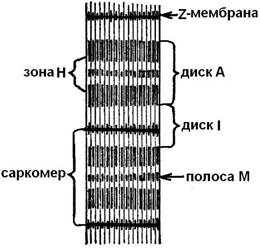
Рис. 5. Участок миофибриллы.
Светлые диски (I) состоят только из тонких протофибрилл, а темные диски (А ) – из протофибрилл двух видов: тонких, скрепленных между собой мембраной, и толстых, сосредоточенных в отдельной зоне (H).
При сокращении саркомера длина темного диска (А ) не изменяется, а длина светлого диска (I) уменьшается, поскольку тонкие протофибриллы (светлых дисков) вдвигаются в промежутки между толстыми (темных дисков). На поверхности протофибрилл расположены особые выросты – спайки (толщиной около 3 нм). В «рабочем положении» они образуют зацепление (поперечными мостиками) между толстыми и тонкими нитями протофибрилл (рис. 6). При сокращении Z -мембраны упираются в концы толстых протофибрилл, а тонкие протофибриллы могут даже накручиваться вокруг толстых. При сверхсокращении концы тонких нитей в центре саркомера заворачиваются, а концы толстых протофибрилл – сминаются.
|
|
|
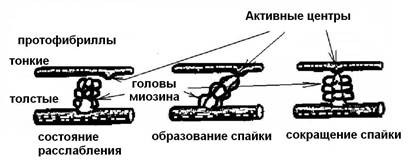
Рис. 6. Формирование спайки между актином и миозином.
Энергообеспечение мышечных волокон осуществляется с помощью саркоплазматической сети (она же – саркоплазматический ретикулум) – системы продольных и поперечных трубочек, мембран, пузырьков, отсеков.
В саркоплазматической сети организованно и управляемо протекают различные биохимические процессы, сеть охватывает все вместе и каждую миофибриллу отдельно. Ретикулум включает рибосомы, они осуществляют синтез белков, и митохондрии – «клеточные энергетические станции» (по определению школьного учебника). Фактически митохондрии встроены между миофибриллами, что создает оптимальные условия для энергетического обеспечения процесса сокращения мышцы. Установлено, что в тренированных мышцах число митохондрий больше, чем в тех же нетренированных.
Химический состав мышц.
Вода с оставляет70 – 80 % веса мышцы.
Белки. На долюбелковприходится от17 до 21 % веса мышцы: примерно 40% всех мышечных белков сосредоточены в миофибриллах, 30% – в саркоплазме, 14% – в митохондриях, 15% – в сарколемме, остальные в ядрах и других клеточных органеллах.
В мышечной ткани содержатся ферментативные белки миогеновой группы, миоальбумин – запасной белок (его содержание с возрастом постепенно снижается), красный белок миоглобин – хромопротеид (его называют мышечным гемоглобином, он связывает кислорода больше, чем гемоглобин крови), а также глобулины, миофибриллярные белки. Болееполовины миофибриллярных белков приходится на миозин, около четверти – актин, остальное – тропомиозин, тропонин, α- и β-актинины, ферменты креатинфосфокиназа, дезаминаза и другие. В мышечной ткани имеются ядерные белки – нуклеопротеиды, митохондриальные белки. В белках стромы, оплетающей мышечную ткань, – основная часть – коллаген и эластин сарколеммы, а также миостромины (связанные с Z -мембранами).
|
|
|
Водорастворимые азотистые соединения. В скелетных мышцах человека содержатся различные водорастворимые азотистые соединения: АТФ, от 0,25 до 0,4 %, креатинфосфат (КрФ) – от 0,4 до 1 % (при тренировке его количество увеличивается), продукты их распада – АДФ, АМФ, креатин. Кроме того, в мышцах содержатся дипептид карнозин, около 0,1 – 0,3 %, участвующий в восстановлении работоспособности мышц при утомлении; карнитин, отвечающий за перенос жирных кислот через клеточные мембраны; аминокислоты, и среди них преобладает глютаминовая (не этим ли объясняется применение глютамата натрия, читайте состав приправ, для придания пище вкуса мяса); пуриновые основания, мочевина и аммиак. Скелетные мышцы содержат также около 1,5 % фосфатидов, которые участвуют в тканевом дыхании.
Безазотистые соединения. В мышцах содержатся углеводы, гликоген и продукты его обмена, а также жиры, холестерин, кетоновые тела, минеральные соли. В зависимости от пищевого рациона и степени тренированности количество гликогена варьирует от 0,2 до 3 %, при этом тренировки увеличивают массу свободного гликогена. Запасные жиры в мышцах накапливаются в ходе тренировок на выносливость. Связанный с белками жир составляет примерно 1%, а в мембранах мышечного волокна может содержаться до 0,2 % холестерина.
Минеральные вещества. Минеральные вещества мышечной ткани составляют примерно 1 – 1,5 % от веса мышцы, это, в основном, соли калия, натрия, кальция, магния. Минеральные ионы, такие как К+, Nа+, Мg2+, Са2+, Сl-, НР04~ играют важнейшую роль в биохимических процессах при сокращении мышц (их включают в состав «спортивных» добавок и минеральной воды).
Биохимия мышечных белков.
Основной сократительный белок мышц – миозин относится кфибриллярным белкам (Молекулярная масса около 470000). Важная особенность миозина – способность образовывать комплексы с молекулами АТФ и АДФ (что позволяет «отбирать» энергию у АТФ), и с белком – актином (что дает возможность удерживать сокращение).
Молекула миозина имеет отрицательный заряд и специфически взаимодействует с ионами Са++ и Мg++. Миозин в присутствии ионов Са++ ускоряет гидролиз АТФ, и, таким образом, проявляет ферментативную аденозинтрифосфатную активность:
|
|
|
миозин-АТФ +H2O → миозин + АДФ + H3PO4 + работа (энергия 40 кДж/моль)
Белок миозин образован двумя одинаковыми, длинными полипептидными α-цепями, закрученными как двойная спираль, рис.7. Под действием протеолитических ферментов молекула миозина распадается на две части. Одна из ее частей способна связываться посредством спаек с актином, образуя актомиозин. Эта часть отвечает за аденозинтрифосфатазную активность, которая зависит от рН среды, оптимум – рН 6,0 - 9,5, а также концентрации КСl. Комплекс – актомиозин распадается в присутствии АТФ, но в отсутствие свободной АТФ он стабилен. Вторая часть молекулы миозина тоже состоит из двух перекрученных спиралей, за счет электростатического заряда они связывают молекулы миозина в протофибриллы.
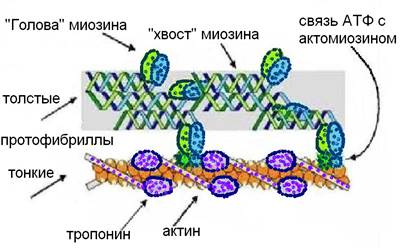
Рис. 7. Структура актомиозина.
Второй важнейший сократительный белок – актин (рис. 7). Он может существовать в трех формах: мономерной (глобулярной), димерной (глобулярной) и полимерной (фибриллярной). Мономерный глобулярный актин, когда его полипептидные цепи плотно уложены в компактную сферическую структуру, связан с АТФ. Расщепляя АТФ, мономеры актина – А, образуют димеры, включающие АДФ: A – АДФ – A. Полимерный фибриллярный актин – двойная спираль, состоящая из димеров, рис. 7.
Актин глобулярный переходит в фибриллярный в присутствии ионов К+, Мg++ и в живых мышцах преобладает фибриллярный актин.
В миофибриллах содержится значительное количество белка тропомиозина, который состоит из двух – α-спиральных полипептидных цепей. В покоящихся мышцах он образует комплекс с актином и блокирует его активные центры, поскольку актин способен связываться с ионами Са++ они и снимают эту блокаду.
На молекулярном уровне толстые и тонкие протофибриллы саркомера взаимодействуют электростатически, так как имеют особые участки – выросты и выступы, где формируется заряд. На участке А-диска толстые протофибриллы построены из пучка продольно ориентированных молекул миозина, тонкие протофибриллы располагаются радиально вокруг толстых, образуя структуру, похожую на многожильный кабель. В центральной М-полосе толстых протофибрилл миозиновые молекулы соединены своими «хвостами», а их выступающие «головы» – выросты направлены в разные стороны и расположены по правильным спиральным линиям. Фактически напротив них в спиралях фибриллярного актина на определенном расстоянии друг от друга встроены мономерные глобулы актина тоже выступающие. В каждом выступе имеется активный центр, за счет которого возможно образование спаек с миозином. Z-мембраны саркомеров (как чередующиеся постаменты) скрепляют между собой тонкие протофибриллы.
|
|
|


