 |
Исследование анодного растворения кобальта и вольфрама в глюконатном электролите.
|
|
|
|
4.2.1 Потенциодинамические измерения
Необходимость подобного исследования диктуется возможностью использования в технологии растворимых анодов. Дело в том, что за небольшим исключением (работы [10,11]) при электроосаждении сплавов из металлов группы железа с тугоплавкими металлами используются нерастворимые угольные (графитовые) или платиновые аноды. Использование растворимых анодов позволяет существенно увеличить работоспособность электролита, что помимо влияния на свойства покрытия, может иметь и положительный экологический эффект, обусловленный переводом в сточные воды отработанного электролита. Одним из достоинств электролитов для получения покрытий из сплавов металлов группы железа с тугоплавкими металлами (в частности, глюконатного электролита для получения Co-W покрытий) является то, что они нейтральные, электроосаждение идет при рН ~ 7. В то же время, например, вольфрам, как правило, анодно растворяется только в щелочных растворах [12].
Анодное растворение W и Co исследовали в ранее описанном глюконатном электролите при двух температурах – 200С и 800С. Для этого использовали два метода: регистрировали анодные потенциодинамические поляризационные кривые при различных скоростях сканирования потенциала (от 5 до 50 мВ/с), а также осуществляли измерения анодного выхода по току измерениями потерь в весе при гальваностатическом включении.
На рис. 4.10, 4.11 приведены анодные поляризационные кривые при использовании в качестве анода Pt (нерастворимый анод), Co и W. Видно, что в отличие от анодного процесса при использовании нерастворимого анода, на котором в этом реализуется кислородный электрод (наблюдается выделение кислорода) Co и W анодно растворяются (имеет место т.н. активное анодное растворение). Очевидная причина того, что не только Co, но и W растворяется в в растворе при рН, близком к нейтральному, заключается в том, что растворение осуществляется в электролите, содержащем комплексы металлов. Однако, если на поляризационной кривой растворения Сo отсутствуют участки пассивации, то при растворении W переход к пассивации имеет место. Критическая плотность тока перехода к пассивности (плотность тока пика на поляризационной кривой) прямо пропорциональна корню квадратному из скорости изменения потенциала, что свидетельствует в пользу диффузионного контроля перехода к пассивности [13] (рис.4.12).
|
|
|
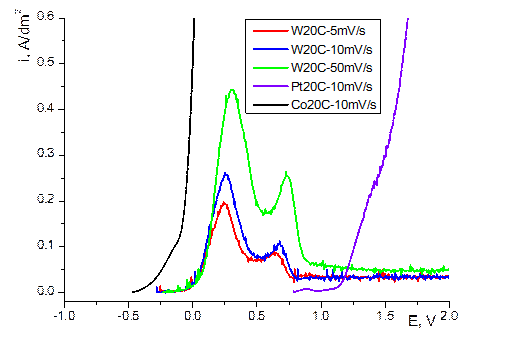
Рис.4.10 Анодные потенциодинамические поляризационные кривые в глюконатном электролите при Т = 200С
 Рис.4.11 Анодные потенциодинамические поляризационные кривые в глюконатном электролите при Т = 800С.
Рис.4.11 Анодные потенциодинамические поляризационные кривые в глюконатном электролите при Т = 800С.
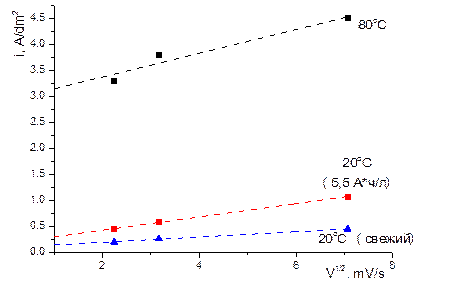
Рис. 4.12 Влияние скорости изменения потенциала на плотность тока перехода к пассивации при анодном растворении вольфрама
Как следует из результатов, представленных на рис. 4.12, плотность тока перехода к пассивации увеличивается при увеличении степени проработки электролита (степени его эксплуатации, A/час. л). Очевидно, что это является следствие такого механизма диффузионных ограничений скорости анодного растворения, при котором на поверхности достигается концентрация насыщения продуктов растворения (комплексного вольфрамат-иона). Результаты, представленные на рис.4.12, одновременно показывают какие анодные плотности тока допустимы при использовании вольфрама в качестве растворимого анода при электроосаждении.
4.2.2 Измерения выхода по току
На рис. 4.13 представлены зависимости выхода по току (рассчитанного на анодное растворение вольфрама в виде шестивалентного) в этом растворе от плотности тока. Видно, что вплоть до плотностей тока ~ 1 A/дм2 растворение осуществляется с выходом по току 95-100% практически независимо от плотности тока при температуре электроосаждения (800С). При температуре 20 0С выход по току снижается. В отличие от растворения W анодное растворение кобальта в этом же интервале плотностей тока происходит с выходом по току 95 -100 %. (Рис 4.14). Снижение выхода по току и при растворении кобальта и вольфрама может быть обусловлено параллельной реакцией разложения воды с выделением кислорода, в особенности, при комнатной температуре (рис.4.13). При температуре электросаждения W также растворяется с выходом по току, близким к 100%.
|
|
|

Рис.4.13 Зависимость выхода по току анодного растворения вольфрама от плотности тока в глюконатном электролите.

Рис.4.14 Зависимость выхода по току анодного растворения кобальта в глюконатном электролите
4.2.3 Выводы
1.Показано, что в исследованном электролите (бор – глюконатном) и вольфрам и кобальт анодно растворяются с выходом по току, близким к 100% при температуре электроосаждения металлов группы железа с вольфрамом, что является основанием использования их в качестве растворимых анодов в технологии получения таких покрытий.
2. Предложен механизм диффузионного контроля скорости анодного растворения в электролитах подобного типа и определены плотности тока перехода к пассивности в условиях работы растворимого вольфрамового анода.
|
|
|


