 |
Селективное культивирование
|
|
|
|
1.Селективное культивирование можно обеспечить с помощью специализированных сред для специфических типов клеток. Бессывороточные среды специального состава были разработаны для культивирования фибробластов человека, опухолевых клеток человека и мыши, лимфобластоидных линий клеток и др. Они отличаются по составу и содержанию таких компонентов как аминокислоты, витамины, антиоксиданты, неорг соли, микроэлементы, липиды, факторы роста, гормоны и другие добавки, т.к. у разных клеток разные пищевые потребности.


Это одно из основных преимуществ бессывороточных сред – возможность приготовления селективных сред для индивидуальных типов клеток. Их куча, и они коммерчески доступны.
2. Использование селективных ингибиторов
Например, в культуральной среде заместили L-валин на D-валин. При этом на среде стали расти клетки, у которых есть D-аминокислотная оксидаза. Так выделили клетки эпителия почечных канальцев, эпителия молочной железы коровы, эндотелиальные клетки крысиного мозга.
Для подавления избыточного роста фибробластов сначала использовали cis-OH-пролин (хотя он и токсичен для других клеток), потом обнаружили, что фенилэтилбарбитуровая кислота ингибирует рост фибробластов в культуре гепатоцитов, потом в культуре панкреатических клеток снизили их рост за счет этилмеркуртиосалицилата натрия. Они также чувствительны к генетицину (в концентрации 100 мкг на мл). Затем открыли перспективный метод – разработали моноклональные антитела к стромальным клеткам карциномы молочной железы человека. Вместе с комплементом эти антитела токсичны для фибробластов из различных опухолей, т.о. можно выделить линии клеток злокачественных опухолей. Также клетки можно селективно убивать конъюгатами антител с токсинами или фарм соединениями.
|
|
|
Трансфецированные клетки отбирают по резистентности к антибиотикам (неомицин, генетицин, гидромицин, метотрексат), включая в генетические конструкции для трансфекции гены устойчивости к антибиотикам. Таким образом, можно проводить селекцию стабильных трансфектантов. А можно проводить негативную селекцию при помощи ТК-гена вируса простого герпеса, который переводит ганцикловир в токсичный продукт. Тогда трансфецированные клетки погибнут.
Если в смеси клеток разная чувствительность к факторам роста, то можно стимулировать фактором роста один тип клеток, и, поскольку растущие клетки более чувствительны, уничтожить их облучением или арабинозида цитозином.
3.Получени мутантных клеточных линий, которые амплифицируют ген дигидрофолатредуктазы.
Если клетки подвергать воздействию ступенчато возрастающей концентрации метотрексата (антагонист фолиевой кислоты), то они приобретают устойчивость к токсическим свойствам этого препарата. Это происходит из-за амплификации гена дигидрофолатредуктазы.
Аналогично можно создать устойчивость к антибиотикам, другим антиметаболитам, токсичным металлам и др.
4.Селективная адгезия
Разные типы клеток обладают разной степенью связывания с субстратом и прикрепляются с разной скоростью. Если первичную суспензионную культуру посеять во флакон и перенести во второй флакон через 30 мин, а затем в третий через час и т.д. до 24 часов, то хорошо прикрепляющиеся клетки будут в первом флаконе, а наименее способные к прикреплению в последнем. Например, макрофаги чаще остаются в первом сосуде, фибробласты в следующих нескольких, эпителиальные клетки в следующих нескольких, а гематопоэтические в последнем.
Если в среде для первичной дизаггрегации тканей используют коллагеназу, то большинство высвобождаемых клеток не будет прикрепляться в течение 48 часов, если не удалять коллагеназу. Но не макрофаги, они мигрируют из фрагментов ткани и прикрепляются даже в присутствии этого фермента. Так их можно отделить. Этот метод используют при дезаггрегации биопсийных образцов опухолей человека.
|
|
|
5.Селективное открепление
При действии трипсина или коллагеназы одни клетки открепляются быстрее других. Наример, периодическая быстрая обработка трипсином удалит фибробласты из культуры фетального кишечника человека и кожи. Также действие коллагеназы на культуру клеток молочной железы в течение нескольких дней приводит к удалению фибробластов, а эпителиальные клетки остаются. А добавление ЭДТА приводит к высвобождению эпителиальных клеток быстрее, чем фибробластов.
6.Природа субстрата
Сейчас лучше изучено действие составных частей среды на селекцию клеток, однако смесь различных коллагенов с протеогликанами, ламинином и другими протеинами матрикса также можно использовать для создания селективных субстратов. Например, известно, что пролиферации эпителиальных клеток способствует коллаген, а дифференцировке и выживанию – матригель (это особая желатинообразная питательная среда, смесь белков, секретируемых клетками саркомы мыши). Также можно использовать пластиковую посуду Primaria (фирма BD Biosciences), имеющую заряд на поверхности. Она способствует улучшению роста эпителиальных клеток по сравнению с фибробластами. BD Biosciences также производит пластик, покрытый синтетическим или природным матриксом, который может облегчать рост требовательных типов клеток, хотя и не очень селективно.
7.Селективные фидерные слои
Для селективного роста эпидермальных клеток можно использовать фидерные слои, также они полезны для сдерживания сверхроста стромальных элементов в культуре клеток молочной железы и карциномы толстой кишки. Фидерный слой обеспечивает не только внеклеточный матрикс для адгезии эпителия, но также предоставлять питательные вещества, факторы роста и компоненты матрикса, способствующие выживанию клеток (чаще используют культуры клеток 3T3, MRC-5, STO). Например, человеческая глиома будет расти на фидерных слоях нормальной глии, в отличие от клеток, полученных из нормального мозга.
|
|
|
8.Селекция на полужидкой среде
Трансформация многих культур фибробластов снижает зависимость клеточной пролиферации от субстрата. Т.о. можно отделять трансформированные клетки от нормальных (нормальные не будут образовывать колонии в суспензии).
Если по каким-то причинам нельзя создать условия для селекции, то возникает необходимость прибегнуть к физическим или иммунологическим методам разделения клеток. Наиболее эффективные методики разделения клеток основаны на различиях в 1. Плотности клеток, 2. Размере клеток, 3. Аффинности антител к эпитопам на клеточной поверхности, 4. Светорассеянии или флюоресценции при сортировке с помощью проточной цитометрии.
1.Плотность клеток и изопикническая седиментация
Разделение по плотности проводят центрифугированием при низких значениях g. В градиенте плотности клетки оседают до равновесного уровня, на котором плотность среды равна их собственной плотности (изопикническая седиментация). Среда должна быть нетоксичная и невязкая. Часто используют перколл (коллоидный кремний) и рентгеноконтрастные йодированные соединения метризамид и метризоат, из которых специально делают градиент, а потом наслаивают клетки.
2.На осаждение клеток влияет их размер. Наслаивание клеток в градиенте позволяет хорошо разделять клетки, только если они значительно отличаются по размеру, и каждая популяция гомогенна по размеру.
3.Существует ряд методик, основанных на специфическом связывании антитела с клеточной поверхностью. Их эффективность зависит от специфичности выбранных антител и доступности эпитопов на поверхности клеток.
- Иммунный лизис (использование антител к нежелательным клеткам).
- Направленная доставка цитотоксина с помощью антите
- Иммунный пэннинг. Основан на прикреплении клеток к чашкам Петри с сорбированными антителами. При этом клетки, к которым специфичны антитела, быстро прикрепляются ко дну чашки, остальное смывают. Бывает положительный иммунный пэннинг (собираем нужные клетки на антитела, а потом собираем с помощью механической обработки или мягкой трипсинизации), так и отрицательный (удаляем ненужные клетки).
|
|
|
- Магнитный сорсинг. Специфические антитела иммобилизованы на ферритиновых гранулах. Клеточную суспензию смешивают с гранулами и помещают в магнитное поле, тогда нужные клетки на гранулах перемещаются к боковой стенке камеры для разделения. После отключения тока клетки отделяют от гранул с помощью трипсинизации или интенсивного пипетирования. Еще один вариант – клетки сорбируются на антителах микропарамагнитных гранул, которые могут связываться с ферромагнитными шариками разделительной колонки при внесении в магнитное поле. Этим методом разделяют многие клетки, в т.ч. стволовые, очищают костный мозг от клеток лейкемии и выделяют эпителий почечных канальцев. Плюс метода с микрогранулами – можно продолжать культивировать и продолжать сортировать клетки без удаления гранул.
4.Флуоресцентно-активируемый клеточный сорсинг
 Разделение клеток с помощью флуоресценции основано на прохождении клеток через лазерный луч, улавливании и регистрации светорассеяния. При этом клетки должны быть обработаны флуоресцентным красителем (йодистый пропидий, хромомицин А3 для окрашивания ДНК) или антителами, мечеными флуорохромом. Прибор – проточный цитометр. Клетки поступают сверху, создается ламинарный поток. Поток клеток выходит из ячейки, его пересекает лазерный луч, генерируется сигнал, который приводит в действие заряженный электрод, при этом потом клеток заряжается. Далее вибрационный излучатель разбивает поток на капли, которые несут заряд и т.о. отклоняются электродными пластинами, которые находятся ниже проточной ячейки.
Разделение клеток с помощью флуоресценции основано на прохождении клеток через лазерный луч, улавливании и регистрации светорассеяния. При этом клетки должны быть обработаны флуоресцентным красителем (йодистый пропидий, хромомицин А3 для окрашивания ДНК) или антителами, мечеными флуорохромом. Прибор – проточный цитометр. Клетки поступают сверху, создается ламинарный поток. Поток клеток выходит из ячейки, его пересекает лазерный луч, генерируется сигнал, который приводит в действие заряженный электрод, при этом потом клеток заряжается. Далее вибрационный излучатель разбивает поток на капли, которые несут заряд и т.о. отклоняются электродными пластинами, которые находятся ниже проточной ячейки.
Таким образом, все клетки со сходными свойствами собираются в одну пробирку. Условие метода – клетки должны различаться по светорассеянию (размер клетки) или флуоресценции (содержание РНК, ДНК или белка, наличие специфических антигенов и др). Широко используют для гематопоэтических клеток.
5. Еще популярные методы для разделения: электрофорез, аффинная хроматография, противоточное распределение.
6. Индуцированные плюрипотентные стволовые клетки.
 ИПСК (iPS- Induced Pluripotent Stem Cells ) - ПСК, полученные из соматических клеток взрослого организма в результате трансфекции специфическим ограниченным набором генов (перепрограммирование клеток путем введения транскрипционных факторов).
ИПСК (iPS- Induced Pluripotent Stem Cells ) - ПСК, полученные из соматических клеток взрослого организма в результате трансфекции специфическим ограниченным набором генов (перепрограммирование клеток путем введения транскрипционных факторов).
Характеристика СК (в целом): неспециализированные, самовозобновление в течение долгого времени, в опред условиях могут быть индуцированы для превращения в специализированные клетки.
|
|
|
СК во взрослом организме: немного, в строго определенных местах (напр, костный мозг), источник для пополнения популяции дифференцированных клеток.
Плюрипотентные клетки (в прямом пути происходят от тотипотентных клеток) - могут дифференцироваться в любой из 3 зародышевых слоев.
iPS-клетки практически идентичны ЭСК (эмбриональным, из бластоцисты) по морфологии, ростовым свойствам, экспрессии специфич маркеров ЭСК, местам метилирования хроматина, времени удвоения, формированию эмбриоидных тел (образующиеся после помещения клеток в культуру), формированию тератом, формированию жизнеспособных химер (клеток исходного родительского генотипа и iPS-клеткок) и способности дифференцироваться.
Различия: ЭСК - из бластоцисты, ИПСК– из клеток взрослого организма (в т.ч. от пациентов с заболеваниями – пациентоспецифичность). «-» ЭСК– возможное развитие иммунного ответа на трансплантат.
Схема получения - репрограммирование соматич клеток в ПСК:
1 - изолирование и культивирование донорных клеток
2 - трансфекция ассоциированных со стволовой клеткой генов в донорные клетки
3 - сбор и культивирование клеток, используя митотически неактивированные фидерные клетки (для опоры и питания ПСК)
4 - небольшое количество клеток становятся iPS-клетками («стираются» дифференцировочные сигналы, полученные в ходе развития клетки, заново приобретают возможность к дифференцировке в различных направлениях) и генерируют подобные эмбриональным колонии стволовых клеток.
(5 – дальнейшая дифференцировка в клетки различных типов)
Предыстория: 1935 - идея «пересадки» ядер дифференцированных клеток в цитоплазму яйцеклетки, чтобы изучить способность к дифференциации.
1962 - пересадка ядра эпителиальной клетки взрослой лягушки в икринку, лишенную клеточного ядра, успешно дает начало нормальному головастику и взрослой лягушке.
Первые ИПСК мыши - 2006 г. Лаб-я Яманаки (Япония) нашла несколько десятков генов, поддерживающих в ЭСК программу плюрипотентности, активность которых намного выше, чем в дифференцированных клетках. Внедрили в фибробласт вектор с 24 генами, заставившими часть клеток дать колонии, подобные СК, по одному удаляли гены и установили 4 гена, необходимых и достаточных для «перепрограммирования» клетки - «коктейль» Яманаки: с-Myc, Oct3/4, Sox2 и Klf4.
Однако сначала не удалось получить жизнеспособные химерные организмы при введении этих iPS-клеток в эмбрионы.
ИПСК получались с крайне низким выходом, однако даже этого достаточно для неограниченно делящихся клеток. Далее - оптимизация состава перепрограммирующих факторов и способов введения вектора для повышения эффективности перепрограммирования и снижения вероятности опухолеобразования. (Пример: Нейрональные стволовые клетки мыши превращаются в ИПСК введением одного только фактора Oct4). ИПСК можно получить, используя не только «коктейль» Яманаки, можно заменять на некоторые другие.
2007 – жизнеспособная химерная мышь.
Зрелые клетки могут быть „перепрограммированы“ обратно в плюрипотентное состояние - Нобелевская по физиологии и медицине (2012, Джон Гардон, Шинья Яманака).
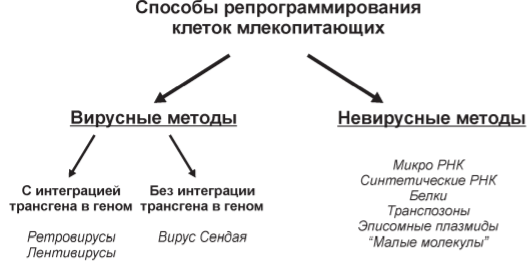 Способы получения ИПСК:
Способы получения ИПСК:
-вирусные системы индукции: ретровирусная, лентивирусная трансдукция (не применяется в клет терапии из-за опасности активации трансгенов в организме и вероятности развития злокачественных заболеваний. Встраиваются в произвольное место генома, могут повредить или запустить программу онкологической трансформации. Эфф-ть – 0,1%). Вирус Сендай из семейства Paramyxoviridae, содержащий одноцепочечную РНК, не интегрирует в геном, его можно удалить, проинкубировав ИПС клетки при температуре 39 С. Полностью репрограммированные клетки обычно получают через 25 дней после инфекции. Эффективность репрограммирования сильно варьирует для разных типов клеток.
-безвирусные методы индукции плюрипотентности: piggyback транспозон, несущий транскрипционные факторы Oct4, Sox2, c-Myc, Klf4, слитые через 2А пептиды, плазмидные ДНК, рекомбинантные транскрипционные факторы (система транспозон-транспозаза (эфф-ть 0,1-1%) предполагает внесение 2 двунитиевых разрывов при встраивании и при удалении, а репарация может происходить с ошибками и мутациями. Репрограммирование неинтегрирующимися векторами и белками – очень низкая эффективность – тысячные доли %).
-индукция ПП с помощью трансфекции соматических клеток мРНК факторов репрограммирования (безопасно, так как Мрнк полностью разрушается в клетке, а ее синтез in vitro не связан с использованием животных материалов. Эффективность – 2%).
«Малые молекулы»: ингибиторы ДНК-метилтрансферазы, метилазы и деацетилазы гистонов, Bayak8644 (активатор кальциевых каналов) повышают эфф-ть репрограммирования в несколько раз, т.к. оно связано с эпигенетическими перестройками.
Необходимым условием эффективного репрограммирования является подавление активности белкового комплекса ремоделирования нуклеосом и деацетилирования – NuRD, экспрессия которого наблюдается во всех типах соматических клеток (ингибирует гены плюрипотентности).
Экспрессия гена Nanog характерна для недифф клеток и является маркером плюрипотентного состояния. Повышенная экспрессия гомодимера белка в ЭСК мыши способствует сохранению недиф состояния.
Источники получения ИПСК: фибробласты кожи (популярно, удобно), нейральные СК (из головного и спинного мозга), эндотелий, кератиноциты кожи (удобно), терминально дифференцированные лимфоциты, гепатоцит, эпителий желудка, волосяных фолликул (удобно), слизистой глаза, мононуклеарных клеток периферической крови.
Процесс репрограммирования у фибробластов: через 3 дня после вирусной инфекции - замолкание фибробласто-специфичных генов с одновременной активацией экспрессии генов, характерных для ЭСК. Удаление репрессивных эпигенетических меток из ключевых генов плюрипотентности и ремоделирование участков хроматина, где находятся гены плюрипотентности. Спустя 10–15 дней - детектируется эндогенная экспрессия Oct4, Sox2 и Nanog, реактивация теломеразы и инактивация Х хромосомы, постепенное замолкание трансгенов.
Помимо ремоделирования клеток через ИПСК, существует процесс трансдифференцировки — превращению одного типа клеток в другой, минуя стадию СК. (фибробласты в миобласты - активация гена MyoD. экзокринные клетки поджелудочной железы в эндокринные, мезодермальные фибробласты в эктодермальные нейроны).
Перспективы использования ИПСК:
- терапевтическое применение ИПСК (лечение заболеваний крови и иммунной системы (в т.ч. генетические), онкологии, бол-ни Паркинсона и Альцгеймера, слепоты, нарушений работы спинного мозга, диабет, ИМ и мн. др. – связаны с гибелью или дисфункцией клеток организма);
- позволяет получать плюрипотентные СК без использования эмбрионов;
- чрезвычайно информативная модель различных наследственных и врожденных заболеваний человека, в т.ч. нейродегенеративных (изучение молекулярных и клеточных основ тяжелых болезней человека in vitro);
-решение проблемы иммунной несовместимости (трансплантология);
-возможность получать линии бессмертных клеток, соответствующих редким генетическим заболеваниям, изучать болезнь и действие ЛС (тест-ситемы для скрининга ЛС in vitro, учитывая индивидуальные особенности пациента), создание банка клеток;
- замещение больных или утраченных клеток прямо в ткани (в перспективе);
- сокращение экспериментов по тестированию новых соединений на клетках животных.
Проблемы, сложности:
- безопасность: ИПСК могут быть онкогенными (в частности, ген с-Myc);
- эффективность репрограммирования (низкий «выход»), сложность обеспечения жизнеспособности клеток после пересадки человеку (клетки могут не прижиться, вызвать иммунный ответ), правильное встраивание.
|
|
|


