 |
Ациклические (цитраль и его изомеры)
|
|
|
|
Терпеноиды. Изопреновое правило. Классификация. Монотерпены.
Ациклические (цитраль и его изомеры), моноциклические (лимонен),
бициклические (α-пинен, борнеол, камфора) терпены. Ментан и его
производные, применяемые в медицине: ментол, терпин. Дитерпены:
ретинол (витамин А), ретиналь. Тетратерпены (каротиноиды), β-
Каротин (провитамин А).
Терпеноиды
Терпеноиды – обширный класс природных органических соединений с общей формулой (С5Н8)n, где n ≥ 2.
Группа терпеноидов однородна биогенетически и представляет собой общую семью близкородственных соединений. Углеродный скелет всех терпеноидов построен из разветвленных изопреновых единиц: СН2=С(СН3)–СН=СН2, содержит (в зависимости от сложности структуры отдельных производных) кратное число таких пятиуглеродных фрагментов (см. таблицу) и образуется из общего предшественника – изопентенилдифосфата. Последний представляет собой фосфорилированный аналог изопрена и известен под названием «активированного изопрена». Классифицируют терпеноиды исходя из теоретического числа единиц изопрена С5Н8 в молекуле (см. таблицу).
Терпеноиды широко распространены в лекарственных растениях. Классификация лекарственного сырья, содержащего терпеноиды, базируется на основных компонентах, обусловливающих терапевтическое действие.

Физ/хим свойства:
Терпеноиды имеют разное агрегатное состояние. Они могут быть жидкими, кристаллическими, аморфными. Имеют различную растворимость в воде, обычно хорошо растворимы в органических растворителях. Монотерпеноиды хорошо перегоняются с водой и водяным паром, сескви – и дитерпеноиды несколько труднее, три-, тетра-, политерпеноиды не перегоняются.
|
|
|
Оптически активные вещества.
Терпеноиды обладают высокой реакционной способностью, особенно на свету. При нагревании легко изомеризуются, особенно легко в присутствии кислых реагентов. Вступают в реакции гидрогенизации, полимеризации.
При нагревании до 7000 и выше деполимеризуются до изопрена.
Терпеноиды широко распространены в лекарственных растениях. Из растений их выделяют различными методами: перегонкой с водой и водяным паром, сухой перегонкой, экстракцией различными растворителями. Методы выделения и анализа зависят от структуры терпеноидов
Изопреновое правило
Структурное единство позволило Ружичке сформулировать в 1921 г. известное «изопреновое правило», согласно которому углеродный скелет терпеноидов состоит из изопреновых фрагментов, связанных в определенном порядке [1,2]. Это правило было использовано при установлении строения сесквитерпеноидов и дитер-пеноидов в последующие десятилетия. Со временем накопилось немалое число примеров формального нарушения правила Ружич-ки. Это привело к новой его формулировке как «биогенетического изопренового правила», учитывающего возможность различных «дозволенных» перегруппировок в ходе биосинтеза. Согласно «биогенетическому изопреновому правилу», терпеноидами являются соединения, изначально образованные комбинацией изопреновых фрагментов, в результате которой возникают гераниол, фарнезол, геранилгераниол, сквален и другие алифатические соединения того же типа [3]. Прочие терпеноиды могут быть получены из этих алифатических предшественников путем обычных реакций циклизации, а в некоторых случаях путем циклизации с перегруппировкой.
Под названием терпены объединяют как углеводороды, так и кислородсодержащие производные, в особенности спирты, альдегиды и кетоны. Большинство известных терпенов построено из изопреновых фрагментов, которые связаны друг с другом по типу присоединения «голова к хвосту» (изопреновое правило, Ружичка, 1921 г.)
|
|
|
Классификация:
|
Монотерпены
Монотерпены — природные углеводороды, образованные сочетанием двух изопреновых фрагментов и, соответственно, общей формулой C10H16[1].
Терпеноиды — кислородные производные монотерпенов — называются монотерпеноидами.
Структура и свойства
По структуре монотерпены делятся на две большие группы: ациклические, с открытой углеродной цепью (например, мирцен, оцимен) и циклические, которые могут содержать как один цикл (лимонен), так и несколько (фенхены, пинены); некоторые бициклические монотерпены содержат циклопропановые циклы(сабинен).
Нахождение в природе
Монотерпены и монотерпеноиды являются основными компонентами многих эфирных масел, у хвойных монотерпены являются основными компонентами летучей фракции живицы —скипидара.
Среди них наиболее распространены пинены (скипидар из сосны обыкновенной Pinus sylvestris содержит до 78 % пиненов) и лимонен (до 90 % в эфирных маслах цитрусовых). Они обладают антисептическим, болеутоляющим и согревающим кожу действием, но при длительном использовании вызывают раздражение кожи и слизистых оболочек.
Монотерпены встречаются в очень многих эфирных маслах, например: камфен в масле можжевельника, петигрейн в масле сосны и др.; дипентен в масле бергамота, кориандра, сладкого укропа, лимона и др.; лимонен в масле бергамота, тмина, моркови, сладкого укропа, лимона, нероли, апельсина и др.; пинен в масле кориандра, кипариса, эвкалипта, сладкого укропа, сосны, розмарина и др.; сильвестрен в масле кипариса, сосны и во многих других древесных маслах.
|
|
|
Ациклические (цитраль и его изомеры)
Цитраль (3,7-диметил-2,6-октадиеналь) — монотерпеновый ациклический альдегид, существует в виде двух изомеров: E-изомера гераниаля и Z-изомера нераля. Цитраль, присутствующий в природных эфирных маслах представляет собой смесь изомеров с преобладанием гераниаля. Правка: не понятно, как гераниаль может быть E - изомером, то есть транс-изомером, когда приведенная в статье структурная формула показывает наличие двух заместителей -СН3 и -СНО по ОДНУ сторону от двойной связи, то есть это цис-изомер! Если же рассматривать только метильные заместители в углеводородной цепи и не касаться функциональной группы -СНО, то все равно непонятно, как гераниаль может быть транс-изомером и по отношению к какой из двух двойных связей в этой молекуле рассматриваются положения метильных групп? Главный принцип Z,E-номенклатуры: для обозначения конфигурации указывают цис- (Z, от немецкого Zusammen - вместе) или транс- (Е, от немецкого Entgegen - напротив). Это значит, что гераниаль это Z-изомер, а не E!
Свойства
Цитраль — бесцветная или светло-жёлтая вязкая жидкость с сильным запахом лимона. Цитраль существует в основном в виде двух изомеров — гераниаля и нераля. Изоцитраль встречается в малых количествах.
Свойства природного цитраля:
· М.м. = 154.25
· Ткип=228-229оС
· d420 = 0.888-0.895
· nd20 = 1,486-1.489
Свойства компонентов цитраля:
· E-Изомер (гераниаль) — формула I (в природной смеси около 90 %)
· Ткип=229оС
· d420 = 0.8898
· nd20 = 1.4896
· Z-изомер (нераль) — формула II
· Ткип=102-104оС
· d420 = 0.8888
· nd20 = 1.4869
· Изоцитраль — формула III (встречается в некоторых эфирных маслах):
· Ткип=95-97оС
· d420 = 0.890
· nd20 = 1.4838
Цитраль является очень реакционноспособным соединением: легко окисляется на воздухе; при действии минеральных кислот превращается в п-цимол; при гидрировании превращается в цитронеллаль; при восстановлении альдегидной группы — в цитронеллол; вступает во все характерные реакции альдегидной группы.
|
|
|
Нахождение в природе
Цитраль содержится в эфирном масле лимонного сорго (лемонграссовом масле, до 85 %), масле кубебы (до 75 %), лимонном, эвкалиптовом и некоторых других эфирных маслах.
Способы получения
Цитраль выделяют из эфирных масел (наиболее удобный способ — обработкой сульфитом или бисульфитом натрия с образованием и дальнейшим выделением кристаллического бисульфитного производного); получают окислением кориандрового масла; взаимодействием геранилхлорида с уротропином (реакцией Соммле) и др.
Применение
Цитраль используют как душистое вещество в парфюмерии и как ароматизатор в пищевой промышленности; как антисептик и противовоспалительное средство; как сырье при получении витамина A; при получении многих душистых веществ (иононов, гераниола, цитронеллола и др.). Входит в состав лекарства для глаз, понижает кровяное давление.
Моноциклические (лимонен)
ЛИМОНЕН (1,8-n-ментадиен), мол. м. 136,24; бесцв. летучая жидкость с приятным лимонным запахом; т. пл. -74,35 °С, т. кип. 175,5-176,5 °С; d4200,8422; nD20 1,4746; [a]D20 +126,84° и -123,7°; давление пара (20 °С) 139,6 Па; хорошо раств. в неполярных орг. р-рителях, не раств. впропиленгликоле, глицерине, воде. Легко окисляется на воздухе; целенаправленным окислением можно получить карвон.

(+)-Лимонен и (—)-лимонен сравнительно устойчивы при термич. воздействии: не превращаются в др. углеводороды при нагр. до 250-400 °С, а лишь постепенно рацемизуются, давая (b)-лимонен, называемый дипентеном, т. пл. -95,5°С, т. кип. 178°С; d420 0,8424; nD20 1,4715; крекинг лимонена идипентена при 500-700°С приводит к изопрену. Лимонен и дипентен в присут. минер. к-т гидратируются с образованием терпинеола итерпингидрата, при каталич. гидрировании превращаются в n-ментан, при дегидрировании - в n-цимол. (—)-Лимонен и дипентен входят в состав почти всех скипидаров и эфирных масел хвойных деревьев. (+)-Лимонен содержится в лимонном масле, запах к-рого обусловлен его присутствием, в померанцевом [до 90% (+)-лимонена], бергамотном, апельсиновом и др. эфирных маслах. (+)-Лимонен и (—)-лимонен выделяют из эфирных масел. Дипентен получают гл. обр. пиролизом a-пинена. Лимонен используют при составлении парфюм. композиций, мыльных отдушек и пищ.эссенций, а также для получения карвона, дипентен - для получения нек-рых душистых в-в и флотореагентов, как р-ритель для лаков, смол и восков. Т. всп. 42°С, т. воспл. 237°С; КПВ 0,75-6,1% по объему: ЛД50 для (+)-лимонена 5 г/кг (крысы, перорально)
бициклические (α-пинен, борнеол, камфора) терпены
Пинен — бициклический терпен (монотерпен). Известны 3 изомера, отличающихся положением двойной связи. Название пиненов происходит от слова Pine — сосна (лат.) — это важный компонент смолы хвойных деревьев,скипидара; эфирные масла многих растений содержат пинены. Пинены хорошо распознаются насекомыми и являются важным регулятором их химической коммуникации (см. хеморецепция).
|
|
|
Систематическое название пиненов:
· 2,6,6-триметилбицикло[3.1.1]гепт-2-ен (2-пинен, α-пинен) (формула I)
· 2-метилен-6,6-диметилбицикло[3.1.1]гептан (нопинен, β-пинен) (формула II)
· 2,6,6-триметилбицикло[3.1.1]гепт-3-ен (δ-пинен) (формула III)
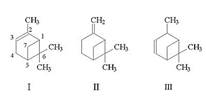
Формула: C10H16
молекулярная масса: 136.24 дальтон
Пинены являются бесцветными жидкостями с запахом сосновой хвои,хорошо растворимы в неполярных органических растворителях, нерастворимы в воде. Окисляются на воздухе, превращаясь в вязкое жёлтое масло.
Пинены весьма реакционноспособны. При мягком нагревании или в присутствии платиновой черни β-пинен легко превращается в α-пинен. При нагревании до 250оС α- и β-пинен превращаются главным образом в дипентен, при температуре выше 400оС α-пинен изомеризуется в аллооцимен и дипентен, а β-пинен — в мирцен. При нагревании выше 700оС пентены превращаются в изопрен и ароматические углеводороды.
Гидрирование пиненов приводит к пинану (2,6,6-триметил[3.3.1]гептану. При мягком гидрировании (платиновая чернь, комнатная температура) образуется в основном цис-пинан, в жёстких — смесь цис- и транс-пинанов.
В присутствии кислотных катализаторов (P2O5, BF3, TiO2) пинены полимеризуются — при действии разбавленных органических и неорганических кислот превращаются в дипентен,терпинолен, терпинены, терпинеол, терпингидрат, в присутствии TiO2 при 150оС изомеризуется в камфен.
При окислении кислорода воздуха α-пинен превращается в смесь кислородсодержащих соединений, главным образом вербенола и вербенона.
При присоединении хлороводорода к α-пинену образуется неустойчивый 2-хлорпинан, который перегруппировывается в борнилхлорид и фенхилхлорид.
Биосинтез
α- и β-пинен образуются из геранил пирофосфата, циклизацией линалилфосфата.

Применение
Пинены — важный компонент для синтеза камфоры и многих других веществ, часто трансформация пиненов производится с помощью окисления с применением селективныхкатализаторов.
Скипидар, а реже α- и β-пинены применяются как растворители лаков и красок, сырьё для получения соснового масла, политерпеновых смол, терпинеола и душистых веществ. β-Пинен используется для синтеза мирцена.
Борнеол (слева) (эндо-1,7,7-триметилбицикло-[1,2,2]-гептанол-2) — относится к терпеновым спиртам.
Изоборнеол (справа) — (экзо-1,7,7-триметилбицикло-[1,2,2]-гептанол-2). 
Свойства
| Тпл, °C | Ткип, °C | Твсп, °C | d420 | [α]D20, ° | |
| (+)- и (-)-Борнеол | 208—209 | 1,01—1,02 | ±37,9 (эфир, бензол) | ||
| (+)- и (-)-Изоборнеол | — | — | ±33,6 (этанол) |
Бесцветные кристаллы с характерным хвойным запахом; плохо растворим в воде, хорошо — в малополярных органических растворителях, в том числе в спиртах.
При окислении борнеол и изоборнеол превращаются в камфору, при действии кислотных катализаторов изоборнеол легче, чем борнеол, дегидратирует с образованием камфена (перегруппировка Вагнера—Меервейна), а также легче образует простые эфиры и труднее - сложные эфиры.
Малотоксичны, однако действуют на центральную нервную систему, снижают артериальное давление.
Нахождение в природе
борнеолы и их сложные эфиры широко распространены в природе. (+)—Борнеол содержится, в частности, в эфирном масле борнейского лавра. (-)—Борнеол, или "нгай-камфора", главный компонент эфирного масла растения Blumea balsamifera. (±)—Борнеол обнаружен во многих эфирных маслах, в то время как изоборнеол - лишь в эфирном масле растенияJuniperus exelsa.
Получение
Борнеолы получают:
· гидролизом борнилацетата;
· выделение из эфирных масел (борнеол);
· гидратацией пиненов (борнеол);
· действием на камфен уксусной или муравьиной кислотой в присутствии кислотного катализатора и последующим омылением эфиров (изоборнеол).
Изоборнеол в настоящее время получают гидратацией камфена в присутствии кислотных катализаторов. Ранее процесс проводили в 2 стадии: этирификацией уксусной или муравьиной кислотой и последующим гидролизом образовавшегося эфира.
Применение
Основной полупродукт получения камфоры.
Борнеол, изоборнеол и их эфиры (борнилацетат, изоборнилацетат) применяют как компоненты парфюмерных композиций и, особенно, отдушек для мыла и товаров бытовой химии.
Ка́мфора, или камфара́ (Camphora) — терпеноид, кетон терпенового ряда.

Свойства
Бесцветные легколетучие кристаллы с характерным запахом; плохо растворима в воде, хорошо — в малополярных органических растворителях, в том числе в спиртах; существует в виде двух оптически активных форм ((d)− и (l)− формы, tпл 178,5—179 °C) и в видерацемической смеси, tпл = 178—178,5 °C.
Синонимы: Камфара́ (устар.), Camphor.
Получение
Камфора распространена в природе, входит в состав многих эфирных масел. Особенно много её в масле камфорного лавра (Cinnamonum camphora), базилика, полыней, розмарина. Эфирное масло камфорного лавра в XIX веке служило основным источником (d)− камфоры, натуральной (японской) камфоры.
· Натуральную d-камфору получают из древесины или смолы камфорного лавра (Япония, Китай, Индонезия)
· Полусинтетическую L-камфору получают из пихтового масла.
· Синтетическую рацемическую-камфору в промышленности получают (в виде рацемической смеси) переработкой скипидара или его основного компонента — α-пинена.
Применение
Камфору используют в медицине и ароматерапии (см. ниже).
В начале XX века камфора широко применялась в производстве некоторых пластмасс, особенно целлулоида — как пластификатор нитрата иацетата целлюлозы, а также как флегматизатор бездымного пороха.
С давних пор камфору и камфорное эфирное масло применяли для борьбы с молью, но в настоящее время, из-за достаточно высокой токсичности, такое её использование заметно снизилось.
В Китае и по всей юго-восточной Азии, камфору использовали в качестве благовонного курения, для чего кристаллы камфоры помещали на раскаленные угли в курильнице.
В некоторых районах Индии, в основном Бенгалии и Ориссе, натуральную камфору используют в кулинарии, как специю при приготовлении сладостей и молочных пудингов.
Натуральную камфору, желательно борнеосскую, используют при создании химического барометра-штормгласса Роберта Фицроя.
Вследствие высокой криоскопической константы камфора используется для определения молекулярной массы методом криоскопии.
Химические свойства

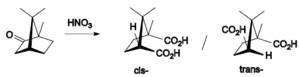

Камфоре свойственны большинство реакций кетонов. Камфора может быть восстановлена до изоборнеола с помощью борогидрида натрия.
|
|
|


