 |
Глава 21. Кольцевые соединения
|
|
|
|
Глава 21
Кольцевые соединения
Вторая основная группа органических соединений – кольцевые соединения. И вновь, кольцевые структуры делятся на три подгруппы. В двух из них положительными компонентами магнитно-нейтральных групп являются атомы углерода. Первая подгруппа – это циклические или алициклические соединения, у которых преимущественная валентность углерода равна 2. Вторая подгруппа – это ароматические соединения, у которой валентность углерода равна 1. У третьей подгруппы - гетероциклические соединения - один или больше атомов углерода в кольце заменяется атомом какого-то другого элемента. Эти три подгруппы подразделяются еще на мононуклеарные и полинуклеарные подразделения; базовая структура последних формируется посредством уплотнения (сгущения) или слияния двух или более колец. Следует понять, что подразделения не исключают друг друга. Соединение может состоять из кольца, присоединенного к одной или более цепей; цепное соединение может обладать одной парафиновой и одной олефиновой ветвью; циклическое кольцо может присоединяться к ароматическому кольцу, и так далее.
Как и у цепных соединений, классификация делит кольцевые соединения на семейства, характеризующиеся природой отрицательных компонентов, - углеводороды, спирты, амины и так далее. Обыкновенный циклический углеводород циклан или циклопарафин – это простое кольцо нейтральных групп CH2. Общую формулу можно выразить как -(CH2)n. Начиная с циклопропана (n= 3), обыкновенные цикланы создаются всеми величинами n, вплоть до более 30. У колец нейтральные группы идентичны нейтральным группам CH2 у цепных соединений и могут расширяться тем же способом – прибавлениями CH2. Следовательно, разветвленным цепным соединениям соответствуют разветвленные кольца, такие как этилциклогексан -(CH2)5 (CH • CH2 • CH3)- и 1-метил-2-этил циклопентан -CHCH3 • (CH • CH2 • CH3) • (CH2)3.
|
|
|
В последующих обозначениях нейтральные группы будут четко определены скобками или другими средствами, и (как и в нейтральных группах цепных соединений) внутри групп будет сохраняться положительно-отрицательных порядок. Чтобы определить вещество как кольцевое соединение и показать, что конечные положения в прямой строке формулы не имеют такой особой значимости, как в цепных соединениях, на каждом конце кольцевой формулы будет использоваться тире, как в вышеприведенных примерах. Если имеются два или более кольца или если часть соединения находится вне кольца, на это будут указывать положения тире. Поскольку при выражении формулы единичного кольца ни одна группа не может считаться стартовой точкой, по возможности, мы будем следовать порядку обычной системы нумерации, чтобы снизить до минимума отклонения от известной практики. То есть, названия ветвей, например, 1-метил-2этил, будут ясно указываться формулой.
У циклического кольца замещение всех двухвалентных групп одновалентными группами там, где замещение реально, преобразовывает циклическое соединение в ароматическое. Однако отдельные ароматические характеристики не появляются до тех пор, пока не завершится замещение. Поэтому в циклическую классификацию будут включены промежуточные структуры, у которых CH или ее эквивалент замещены на CH2 только в части кольцевых положений. Поскольку присутствие оставшихся групп CH2 является главным определителем молекулярных свойств, превалирующей валентностью углерода, в том смысле, в каком этот термин используется для определения классов кольцевых соединений, будет 2, даже если в молекуле имеется больше групп СН, чем CH2.
|
|
|
Как уже упоминалось, в молекулярных соединениях вероятности благоприятствуют объединению подобных сил. Группы CH2 обладают достаточной гибкостью геометрической компоновки для компенсации существенных вариаций. Следовательно, единичные группы CH2 могут без труда увязываться с молекулярной структурой. Группы СН обладают небольшим геометрическим дрейфом, и поэтому они почти всегда существуют в парах. Это не значит, что индивидуальная группа не может существовать отдельно, и в некоторых более сложных структурах можно обнаружить единичные группы СН. Но у простых колец пары настолько вероятнее, чем нечетные количества групп, что последние исключаются.
Первое двухгрупповое замещение в цикланах создает циклены или циклоолефины. Типичное соединение - циклогексан -(CH2)4 • (CH)2. Исходя из выводов этой работы, производные циклопарафина и циклоолефина невозможны, поскольку циклопарафины не содержат атомов углерода с характеристиками валентности парафина. Циклоолефины формируются замещением двухвалентных групп ацетилена на кольца CH2. Поэтому предпочтительнее названия циклан и циклен.
Замещение еще двух групп СН в кольце создает циклодиены. Существование двух пар CH • CH в этих соединениях вносит новый фактор - положения пар внутри кольца могут меняться. В связи с циклопентадиеном (CH)Q•CH2 - первым соединением в этих сериях - вопроса не возникает, но у циклогексадиена возможны две разные компоновки: -(CH)4• (CH2)2, известная как 1, 3-циклогексадиен, и -(CH)2 • CH2 • (CH)2 • CH2, являющаяся 1, 4-циклогексадиеном.
У циклических соединений отрицательные атомы водорода могут замещаться эквивалентными атомами или группами так же, как отрицательные атомы водорода, содержащиеся в магнитно-нейтральных группах цепных соединений. Конечные продукты, такие как циклогексил хлорид -(CH2)5 • CHCI-, циклогексанол -(CH2)5 • CHOH-, циклогексаламин -(CH2)5 • CHNH2, и так далее, обладают свойствами, похожими на свойства эквивалентных цепных соединений - хлоридов, спиртов, аминов и так далее.
У обычных циклических колец нет атомных групп, обладающих свободой геометрической компоновки, сравнимой со свободой радикалов на обоих концах алифатических цепей. И заменители (у цепей ограниченные радикалами) совсем не появляются у циклических соединений до тех пор, пока ветвь не становится достаточно длинной для того, чтобы поместить конечную группу вне действия сил, возникающих в кольце. В этом случае структура действует как комбинация цепного и кольцевого соединения. Из-за геометрического ограничения область заменителей у обычных видов циклических соединений значительно уже, чем у цепей. Кроме вышеупомянутых CI, OH и NH2 список включает оставшиеся галогены, кислород, CN и CO • OH.
|
|
|
Соединения, образованные прямым замещением двух атомов водорода группы CH2 на кислород называются кетонами, но они не обладают кетонной структурой, поскольку возникающая группа СО становится частью кольца и магнитно-нейтральной группой. Первое замещение создает циклогексанон -(CH2)5 • CO-. Второе замещение создает соединение 1, 3-циклогександион -CO • CH2 • CO • (CH2)3-. Замещение СО может расширяться до циклогексан гексона -(CO)6, у которого уже не остается водорода. Также кислород может быть одновалентным, вместо двухвалентного; в таком случае мы получаем такое соединение как циклогексил метил эфир -(CH2)5 • (CH • OCH3)-.
Дополнительные семейства соединений создаются как вторичными замещениями, выливающимися в структуры порядка циклогексил ацетата -(CH2)5 • CH(O • CO • CH3)-, так и параллельными замещениями двух или более нейтральных групп. Примером вида структуры, создающейся множественными замещениями, является 1, 2, 3-циклопропанэтрикарболсиловая кислота -(CH • CO • OH)3-. Естественно возникающие соединения этого циклического класса являются сильно ветвящимися кольцами, начиная с таких соединений как ментол -CHCH3 • CH2 • CHOH • (CH • CHCH3 • CH3) • (CH2)2 и кончая очень сложными структурами. Но все они следуют тем же общим структурным паттернам, что и более простые циклические соединения. Поэтому дополнительное обсуждение не требуется.
Как уже упоминалось, группы CH2 обладают значительной степенью структурной широты за счет трехатомного состава. Угол между действующими линиями силы варьируется от почти 120º у циклопропана до менее 15º у самых больших циклических колец, изученных до настоящего момента. Двухатомные группы, такие как СН, не обладают такой структурной свободой и ограничены узкой областью вблизи 60º. Теоретически, точные пределы еще не установлены, но трудности, связанные с созданием производных циклооктатэтрина -(CH)8, указывают, что это соединение пребывает на пределе устойчивости. Это допускало бы максимальное отклонение почти 15º от угла в 60º у кольца, состоящего из шести членов. Атомы, из которых состоят молекулярные соединения, обладают ограниченной областью, в которой они могут принимать положения выше или ниже центральной плоскости молекулы. Поэтому реальные углы между действующими линиями силы слегка отклоняются от вышеприведенных цифр, основанных на положениях в центральной плоскости. Но это не влияет на следующий вывод: циклическое кольцо очень гибкое, а ароматическое кольцо практически жесткое.
|
|
|
До тех пор, пока у кольца имеется хотя бы одна группа CH2, оно обладает циклической гибкостью. Несмотря на жесткость части кольца, занимаемой четырьмя группами СН, циклопентадиен существует потому, что группа CH2, завершающая структуру, может приспосабливаться к положению, необходимому для закрытия кольца. Но если все трехатомные группы замещены двухатомными группами или единичными атомами, кольцо становится таким же жестким, как ароматическое. Например, циклобутадиен состоял бы только из четырех групп CH2, и максимальное отклонение линий силы СН (где-то рядом с 75º ) меньше, чем 90º, которое потребовалось бы для закрытия циклобутадиенового кольца. Поэтому все попытки создать такое соединение потерпели неудачу.
Свойства разных кольцевых соединений в значительной степени зависят от следующего фактора: ограничиваются ли члены колец некими определенными положениями или обладают существенным диапазоном изменчивости, внутри которого они могут приспосабливаться к требованиям для соединения. В свете естественной пограничной линии ароматическая классификация (как она используется в этой работе) ограничивается жесткими структурами, особенно соединениями, полностью состоящими из одновалентных групп СН или их одновалентных заместителей, исключая структуры, связанные с вероятно присутствующими атомами углерода.
Из-за ограничений на положения атомов ароматические соединения (за исключением циклооктатэтрана) ограничиваются шестичленными кольцами, одновалентными эквивалентами циклогексана и его производными, а циклобутан, циклогептан и так далее не имеют ароматических аналогов. Структурная жесткость в значительной степени ограничивает подвижность атоматических колец в образовании соединений, но это компенсируется другими влияниями того же фактора. Положения в цепных соединениях, открытые наибольшему разнообразию положений, - это концы цепи и более длинные ветви, если таковые имеются.
|
|
|
У ароматических колец положение каждого кольца до некоторой степени обладает свойствами конца. Вследствие негибкости кольца максимальное расстояние между группами 1-3 в кольце на 10% меньше, чем расстояние между эквивалентными группами в алифатической цепи после принятия в расчет небольшой существующей гибкости. Это позволяет некоторые дополнительные комбинации элементов в пределах действия свободных электрических смещений. У этих колец мы находим не только группы COH, CCI, CNH2 и так далее - одновалентные эквиваленты комбинаций, составляющих циклические кольца и внутренние части цепных соединений, но и другие комбинации, такие как CNO2 и CSH, пребывающие выше магнитно-нейтральных пределов у неароматических структур. Количество доступных комбинаций, у которых нейтральная группа СО сопровождает отрицательный радикал, тоже увеличивается.
Вторичные замещения увеличивают длину и расширяют разнообразие магнитно-нейтральных групп кольца, что создает широкое разнообразие одноветвистых соединений порядка изобутил бензола -(CH)5 • (C • CH2 • CHCH3 • CH3)- и N-этила анилина -(CH)5 • (C • NH • CH2 • CH3)-. Основная причина разнообразия мононуклеарных ароматидов - способность к множественному ветвлению. Ароматические кольца обладают не только большим разнообразием доступных заместителей, чем любой другой вид молекулярного соединения, но и большим количеством положений, куда можно вводить эти заместители. Такая подвижность осложняется тем, что у колец, как и у цепей, порядок последовательности групп обладает определенным влиянием на свойства соединения. Например, поведение 1, 2-дихлорбензола -(CCl)2•(CH)4, во многих отношениях сильно отличается от поведения 1, 4-дихлорбензола -CCl • (CH)2 • CCl • (CH)2.
Значимой характеристикой ароматических колец является способность использовать большее количество менее подвижных заместителей. Например, сведение таких групп, как NO2, к роли отрицательного радикала в цепях означает, что в любом цепном соединении может существовать лишь одна такая группа до тех пор, пока ветвь не становится настолько длинной, что соединение действует как союз двух цепей. У ароматического кольца такое ограничение отсутствует, и весьма распространены соединения с тремя или четырьмя высоко реактивными азотными группами у кольца из шести членов. Список включает такие известные вещества как пикриновая кислота (2, 4, 6-тринитрофенол) -COH • CNO2 • CH • CNO2 • CH • CNO2-, и тротил (2, 4, 6-тринитротолуол) -CH3 • CNO2 • CH • CNO2 • CH • CNO2-.
У ароматических колец, поскольку в группе СН имеется лишь один атом водорода, заместители ограничены одновалентными, отрицательными компонентами. Для установления валентного равновесия с двухвалентным атомом или радикалом требуется два ароматических кольца. Поэтому двухвалентные атомы или группы создают способы объединения двух колец. Например, дифенил эфир обладает структурой -(CH)5 • C-OC • (CH)5-, у которой атом кислорода не является членом ни одного кольца, но участвует в валентном равновесии. Аналогично, двухвалентный, отрицательный радикал NH создает дифенил амин
-(CH)5 • C-NH-C • (CH)5-.
Каждое из колец является очень устойчивой структурой с минимум одиннадцатью заменяющими атомами и вероятностью значительного увеличения посредством замещения. Таким образом, такой способ объединения колец - довольно доступный процесс строительства молекул большого размера. Дальнейшие прибавления и замещения можно делать не только в кольцах и их ветвях, но и в связующих звеньях между ними. Так, прибавление двух групп CH2 к дифениловому эфиру создает дибензил эфир -(CH)5 • CCH2 • O • CH2 C • (CH)5-.
Согласно определению ароматического соединения, такие многокольцевые структуры не являются чисто ароматическими, поскольку под определение не подходят связующие звенья. Мы столкнемся с этой ситуацией, несмотря на то, как создаются разные органические классификации, поскольку более сложные соединения являются преимущественно комбинациями разных основных видов структуры. Обычно соединение классифицируется как кольцевая структура, если оно содержит кольцо любого вида, даже если кольцо может быть лишь небольшим придатком на длинной цепи. Соединение считается ароматическим, если присутствует, по крайней мере, одно ароматическое кольцо.
У многокольцевых соединений комбинация (CH)5 • C - бензоловое кольцо меньше одного атома водорода - действует как одновалентный, положительный радикал - радикал фенила, и простые замещенные соединения могут называться либо производными бензола, либо соединениями фенила; то есть, хлорбензолом или фенил хлоридом. Общая положительная одновалентность – это валентное условие, при котором кольцо сохраняется, если убирается атом водорода; но общая валентность создается в основном за счет валентности +1 одного атома углерода, от которого отделяется атом водорода. Все остальные группы остаются нейтральными, но из этого необязательно следует, что валентность углерода останется +1. Как уже подчеркивалось, валентность – просто вопрос ориентации вращения, и, действуя в одиночку, любой атом может принимать любую из возможных валентностей, если в окружающей среде не существует никаких определенных препятствий. Поэтому один атом углерода свободно приспосабливается к разной окружающей среде посредством переориентации на основе любой из альтернативных валентностей: +2, +4 или –4.
Если соединяются два радикала фенила, межатомные силы будут стремиться установить равновесие. Предпосылка для равновесия сил - равновесие валентности. Следовательно, атомы углерода будут переориентироваться так, чтобы сбалансировать валентности. Имеются два возможных способа достижения результата. Поскольку углерод обладает лишь одной отрицательной валентностью (–4), один атом углерода принимает эту валентность, второй атом должен принимать валентность +4, чтобы прийти к равновесию. У комбинации двух фениловых групп валентные изменения могут происходить у двух независимых атомов углерода без всякой модификации нейтральных групп. Поэтому это самая вероятная структура в таких соединениях как бифенил -(CH)5 • C-C • (CH)5-. Для формирования азобензола -(CH)5 • CNNC • (CH)5- в комбинацию с четырехвалентными атомами углерода можно ввести аналогично сбалансированные пары атомов азота с положительной и отрицательной валентностью 3.
Альтернатива - совершение обоих валентных изменений в той же группе фенила, придавая одному атому углерода валентность (–4) и увеличивая валентность атома углерода в соседней, нейтральной группе от +1 до +4. Результат – кольцо с четырьмя нейтральными группами СН: группой СН с результирующей валентностью +3 и единичным атомом углерода с валентностью (–4). С помощью этой операции группа фенила меняется с одновалентного, положительного радикала C • (CH)5 до одновалентного, отрицательного радикала (CH)4 • CH • C. Подобно группе метила, которая может действовать либо как положительный радикал CH3 с валентностью +1, либо как отрицательный радикал CH2 • H с валентностью (–1), группа фенила способна соединяться с веществами любого вида валентности, принимая отрицательную валентность в комбинации с положительным компонентом и положительную валентность в комбинации с отрицательным атомом или группой. Она отрицательная во всех соединениях фенила металлоорганического класса и образует не только такие соединения, как фенил меди Cu-C • (CH)5- и дифенил цинка Zn(-C • (CH)5-)2, но и комбинации фенил-галоидных структур, такие как фенил олова трихлорид SnCl3-C • (CH)5-.
В комбинации с радикалом CH3 группа фенила положительная. Любой радикал может принимать любую валентность, но вероятности группы метила почти равны, а у группы фенила вероятнее положительная валентность, поскольку кроме удаления атома водорода в бензоловом кольце не совершается никакое изменение. Поэтому комбинация -(CH)5 • CCH3- является толуолом с положительным фенилом и отрицательным метилом (двухвалентным углеродом), а не фенил метаном с отрицательным фенилом и положительным метилом (четырехвалентным углеродом).
Эта разновидность недоступна в комбинации с другими углеводородными радикалами или с самим углеродом. В таких соединениях радикал фенила заменяет водород и является отрицательным. Например, дополнительные замещения фенила сводят радикал CH3 к радикалу CH2. Эта группа не может иметь результирующую валентность (–2), которая понадобилась бы для соединения с положительными радикалами фенила, и у получающегося соединения – дифенил метана - обе группы фенила принимают отрицательный статус. Аналогично, олефиновые и ацетиленовые бензолы обладают такой структурой, у которой радикал фенила отрицательный. Например, стирол – это не винилбензол -(CH)5 • C-CH2 • CH, поскольку эта комбинация содержала бы два положительных компонента и ни одного отрицательного. Это фенил этилен CH • CH2 • -C • (CH)5-, у которого СН положительна, а группа фенила отрицательна.
Интересное соединение фенила – фенил ацетилен, традиционная формула которого C6HS • C • CH. На основании нашего вывода, что водород отрицателен к углероду, атом водорода в ацетилене СН был бы отрицательным. Но это не так, поскольку его можно заменить натрием. Тогда кажется очевидным, что это фенил карбид -(CH)5 • CC2H - соединение аналогичное бутадиену, которое мы уже определили как карбид C • CH • C2H. Как уже замечалось, относительная отрицательность углерода и водорода не имеет значения в связи с радикалом карбида, обладающим результирующей, отрицательной валентностью, и не может быть никакой другой, кроме отрицательной, невзирая на то, с каким элементом или группой он соединяется. Согласно учебникам, соединение фенила определяется как ацетилен потому, что “вступает в типичные реакции ацетилена”. Но то же самое делает любой другой карбид. У первых велосипедистов ацетиленовая лампа была “карбидной лампой”.
Как и радикал фенила, циклические радикалы могут приспосабливаться либо к положительному, либо отрицательному положению в молекуле. Эти радикалы положительны в монозамещенных соединениях. Замещение метила создает гексгидротолуол, а не циклогексил метан. Но если в группе метила имеются два циклических замещения, оба они отрицательные, а результат - дициклогексил метан.
Сейчас было бы желательно исследовать влияния разных модификаций кольцевой структуры на сцепление молекулы. За основную ароматическую структуру можно принять бензоловое кольцо. Учебники и монографии по ароматическим соединениям обычно содержат главу или, по крайней мере, обширный раздел о “проблеме бензола 69”. По существу, проблема в следующем: все сообщения, основанные на наблюдении и эксперименте, указывают на то, что межатомные силы и расстояния между любыми двумя из шести групп СН в кольце идентичны. Но теория химической “связи” не способна рассматривать структуру молекулы бензола, не используя два или более вида связей. Современное решение проблемы – смести ее под ковер посредством допущения, что при переходе от одной компоновки к другой связи структуры меняются или “резонируют”.
СТОВ показывает, что силы между группами в бензоловом кольце действительно идентичны. Однако, как подчеркивалось в предшествующем обсуждении, существование и природа химических соединений не определяются силами сцепления между атомами различных элементов, а отношениями направлений, которые могут принимать вращения атомов, чтобы позволить элементам с электрическим вращением во времени устанавливать устойчивые равновесия сил в пространстве. Результаты теории согласны с тем, что влияния ориентации, позволяющие группам СН комбинироваться в бензоловое кольцо, принимают два разных вида: ближнее и дальнее. Также они раскрывают, что природа ориентирующих влияний не оказывает действия на величину межатомных сил. И это объясняет, почему разница между этими силами не может быть обнаружена экспериментально. Силы между двумя любыми нейтральными группами СН идентичны.
Поскольку факторы ориентации вынуждают атомы выравнивать вращение в конкретных особых относительных направлениях, в определенном смысле они являются силами. И чтобы отличить их от реальных сил сцепления, удерживающих вместе атомы, группы и молекулы в положениях, определенных факторами ориентации, применительно к ориентации мы будем пользоваться термином ”влияния”, а не “силы”, хотя это внесет в изложение элемент неуклюжести. Природу влияний в связи с бензоловым кольцом можно проиллюстрировать схемой ориентации, уже представленного вида.

На схеме пары групп CН 1-2, 3-4 и 5-6, удерживаются в комбинированных положениях влияниями ориентации направленного характера, которые оказываются всеми магнитными группами или соединениями. Альтернативные группы 1-3, 2-4 и так далее пребывают в пределах единицы расстояния, и, следовательно, в пределах действия влияний ориентации. Например, первичное влияние группы 1 направлено к группе 2, но группа 3 тоже пребывает внутри единицы расстояния. Поэтому имеются дальнее вторичное влияние 1-3 и ближнее первичное влияние 1-2. Вследствие направленной природы влияний ориентации, первичное влияние 2-3 отсутствует, но пары 1-2 и 3-4 удерживаются в положениях, обусловленных вторичными влияниями 1-3 и 4-2.
Если заменить один из атомов водорода на какой-то отрицательный заместитель, ситуация ориентации не изменится. Новая нейтральная группа или та часть ее, которая пребывает в пределах действия сил кольца, если группа длинная, берет на себя функции неизмененной группы СН. Однако удаление атома водорода и преобразование молекулы бензола в положительный радикал фенила меняет паттерн ориентации:

Сейчас вторичное влияние 3-5 устранено, поскольку единичный атом углерода не обладает характеристикой свободного электрического вращения магнитных групп или соединений, но оставшихся влияний ориентации еще достаточно для удержания структуры вместе. Дальнейшее изменение валентности, необходимое, если радикал фенила принимает отрицательную валентность, устраняет вторичное влияние 4-2, поскольку группа 4 больше не является магнитной. Два атома углерода и один атом водорода объединяются в радикал ССН, результирующая валентность которого составляет (–1). Этот радикал не оказывает ориентирующего влияния на соседей, но на него влияют соседние, магнитно-нейтральные группы. Паттерн ориентации принимает вид:
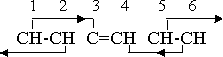
Как уже объяснялось, атомы углерода в комбинации ССН обладают валентностями +4 и (–4). Убирая атом водорода из этой группы, мы получаем кольцо, у которого четыре нейтральные группы СН комбинируются с двумя индивидуальными атомами углерода. Эта структура нейтральна и способна существовать как независимое соединение. В отличие от молекулы метилена она так и поступает, потому что обладает сильной тенденцией к формированию двойного кольца. Четыре группы СН, примыкающие к комбинации С-С, могут дублироваться на противоположной стороне линии действия С-С, формируя еще одно подобное кольцо, использующее ту же пару атомов углерода как часть своей кольцевой структуры. Дело в том, что влияния, возникающие в результате свободных электрических вращений, оказываются атомами углерода групп СН лишь на одной стороне. Они никоим образом не пересекаются с существованием подобных влияний на другой стороне. Отношения ориентации на второй стороне идентичны отношениям на первой стороне. Ни одно кольцо не может забрать атом водорода и стать радикалом фенила потому, что присутствие другого кольца препятствует приближению свободных атомов водорода. Следовательно, соединение с двумя кольцами обладает высокой степенью устойчивости.
Пример такого соединения – нафталин -(CH)4 • C=C • (CH)4 - уплотненный кольцевой ароматический углеводород. В этой работе в формуле соединения двойная линия между двумя атомами углерода - это символ, указывающий на структуру вида уплотненного кольца, у которой кольца связаны в двух положениях, а не в одном как у таких соединений, как бифенил. Этот символ не имеет ничего общего с “двойными связями” электронной теории.
Третье кольцо, прибавленное таким же способом, образует антрацин. Дальнейшие линейные прибавления создают такие серии соединений как нафтацин, пентацин и так далее. Но совсем не обязательно, чтобы прибавления делались линейно. Поэтому каждое соединение сопровождается другими соединениями, имеющими тот же состав, но разные структуры. Например, соединения состава нафтацена, состоящие из четырех колец (C18H12), включают хризен, нафтантрацен, 3, 4-бензофенантрен и трифенилден. Пирен обладает теми же четырьмя кольцами, но более компактной структурой и составом C16H10.
Структурное поведение уплотненных колец, по существу, то же, что у единичных колец бензола. Они объединяются для формирования таких соединений как биантрил и банфтил и действуют как радикалы (нафтил, антрил, фенантрил и так далее). Посредством замещения на водород они присоединяют больше колец, создавая такие соединения как трифенил антрацен. С помощью других отрицательных заместителей, доступных ароматическим кольцам, они формируют огромное разнообразие соединений. В эту категорию входят многие интересные и важные соединения, но у них нет новых структурных характеристик. Поэтому они пребывают вне сферы настоящего обсуждения.
Для устойчивости не требуются две группы СН среднего кольца структуры антрацина, и их можно убрать. Полученное соединение – бифенилен -(CH)4 • CC=CC • (CH)4. Структура с одной группой СН в среднем кольце, промежуточная между антрацином и бифениленом, исключается низкой вероятностью непрерывного существования единичной группы СН, но подобное соединение может формироваться помещением группы CH2 в промежуточное положение, поскольку группы CH2 не ограничены пребыванием в парах. Новое соединение – флуорен. Другая группа CH2 в противоположном положении восстанавливает структуру антрацина в циклическом среднем кольце. Такое соединение называется дигидроантрацином.
Как уже упоминалось, кольцо даже с одной группой CH2 значительно отклоняется от типичного ароматического поведения, поэтому любое такое кольцо классифицируется как циклические структуры. Но этот эффект ограничивается определенным кольцом, а любые прилегающие ароматические кольца сохраняют ароматический характер. Поэтому такие соединения как флуорен дигидроантрацин должны рассматриваться как комбинация цикло-ароматических структур. Таких соединений очень много, они разнообразны, но принципы комбинирования те же, что и у чисто ароматических соединений, и не нуждаются в повторении. Поскольку циклические соединения менее устойчивы, чем соответствующие ароматические соединения, структуры комбинаций не охватывают такую большую область, как ароматические соединения. Но такая устойчивая структура как нафталин проходит через всю область замещения. Начиная с чисто ароматического соединения, последовательные пары атомов водорода могут прибавляться до образования чисто циклического соединения - декагидронафталина.
Уменьшение разнообразия комбинационных структур, за счет ослабления силы сцепления в циклическом кольце по сравнению с ароматическим кольцом, в некоторой степени препятствуют способности групп CH2 формировать кольца разных размеров. Например, 1, 2, 3, 4-тетрадронафталин может терять одну из групп CH2 и формировать индан -(CH)4 • C=C • (CH2)3-. Из-за гибкости группы CH2, циклическое кольцо в этом соединении способно замыкаться, даже если две оставшиеся группы CH2 заменяются СН. Это создает инден -(CH)4 • C=C • (CH)2 • CH2.
Полинуклеарные циклические соединения образуются так же, как полинуклеарные и комбинационные структуры, но значительно уступают им в разнообразии. Бифенилу и его продуктам замещения соответствуют дициклопентил, дициклогексил и так далее и их производные; трипентил метан имеет циклический эквивалент трициклогексил метан; циклическим аналогом нафталина является бициклодекан и так далее.
Последнее основное подразделение кольцевых соединений – гетероциклическая группа. В нее входят все соединения, у которых любые атомы углерода в циклических или ароматических кольцах замещаются другими элементами. Основная причина выделения этих соединений в особую группу в том, что большинство замещений углерода другими элементами требует валентных изменений того или иного вида, в отличие от замещений водорода, которые обычно не включают валентных модификаций (кроме тех случаев, когда два одновалентных атома водорода заменяются двухвалентным заменителем).
Некоторые гетероциклические замещения являются замещениями двух групп; в таких случаях обычная циклическая или ароматическая структура не меняется. Например, начиная с хинона -(CH)2 • CO • (CH)2 • CO- (ароматического соединения углерода) и заменяя две группы СН нейтральными группами NH, мы получаем урацил -NH • CO • NH • CH • CH • CO-. Еще одно парное замещение убирает последние углеводородные группы и создает уразин -NH • CO • NH • NH • CO • NH-. У уже упомянутого сложного циклогексан гексона заменен весь водород, а у боразола BH • NH • BH • NH • BH • NH- убирается весь углерод. Все эти гетероциклические соединения состоят исключительно из двучленных, магнитно-нейтральных групп и, следовательно, обладают структурой бензола - шестью группами, организованными в жесткое ароматическое кольцо.
Чаще всего гетероциклический заместитель – это единичный атом или радикал. И для поддержания валентного равновесия такое замещение требует изменения валентности в какой-то другой части кольца. Поэтому замещения часто происходят в виде сбалансированных пар. Например, у пирона -(CH)2 • CO • (CH)2 • O- комбинация СО не является нейтральной группой, а радикалом с валентностью +2, балансирующим валентность (–2) атома кислорода. Радикал CH2, у которого углерод имеет обычную валентность +4, играет ту же роль у пирана -(CH)2 • CH2 • (CH)2 • O-. Замещение двух атомов азота со сбалансированными валентностями +3 и (–3) в ароматическом кольце создает диазин. Если атомы азота находятся в положениях 1, 2, соединение называется пиридазин -N•N•(CH)4. Свойства соединений 1, 3 и 1, 4 достаточно отличаются от свойств пиридазина, поэтому им даются другие названия, соответственно пирамидин и пиразин.
Поскольку положительные и отрицательные радикалы в кольце не обладают фиксированными положениями (подобно двум концам цепей), их статус невозможно определить положениями, как мы делали это в формулах цепных соединений. Чтобы формула представляла реальную структуру настолько точно, насколько это возможно, следует разработать подходящий метод определения. В целях настоящего обсуждения это не обязательно и может подождать до дальнейшего изучения.
Нижеприведенные схемы пирана и пиридазина типичны для гетероциклических соединений с замещениями одного атома или радикала:

Если равновесие валентности не устанавливается с помощью пары заместителей, необходимо изменение валентности одной из нейтральных групп. Замещенный в кольце единичный атом азота где-то в структуре требует валентности +3, чтобы сбалансировать отрицательную валентность азота. Это легко выполняется посредством сдвига валентности одного из атомов углерода до +4. Тогда реконструированное кольцо состоит из атома азота с валентностью (–3), радикала СН с валентностью +3 и четырех нейтральных групп СН. Такое соединение называется пиридином -(CH)5 • N-. Гидратация может выполняться шаг за шагом, посредством промежуточных соединений, вплоть до соответствующей циклической структуры - пиперидина -(CH2)5 • NH-.
Если в ароматическое кольцо вводится кислород или другой отрицательный двухвалентный компонент, необходимое балансирование валентности может достигаться последовательным замещением одной из нейтральных групп СН на радикал CH2, как уже отмечалось в случае пирана. Или требуемого равновесия можно достичь без введения дополнительного водорода, если валентность углерода в двух группах СН повышается до уровня +2 (первичная магнитная валентность), образуя два радикала СН, каждый из которых имеет валентность +1. В кольце, состоящем из шести членов, остается нестабильное нечетное число нейтральных групп СН, но структура обладает достаточной гибкостью для замыкания кольца на базе пяти членов. Стабильность восстанавливается испусканием нейтральной группы. Возникающее соединение называется фураном -(CH)4


