 |
крА + крВ →LE (Ф=3 и С=0).
|
|
|
|
При этой температуре система остается до тех пор, пока не исчезнет одна из фаз. В данном случае полностью расплавятся кристаллы вещества А, а кристаллы вещества В — частично. Находящиеся в избытке по отношению к эвтектике, кристаллы В останутся в равновесии с жидким раствором.
Система снова становится двухфазной ( С=1 ) и ее температура повышается. Происходит дальнейшее плавление системы крВ→ L . Кристаллы В , расплавляясь, изменяют состав жидкой фазы, согласно правой ветви ликвидус. Ее состав при определенной температуре легко найти с помощью конноды. Заканчивается плавление полным исчезновением кристаллов В при температуре Т2 .
Кривая охлаждения сплава b аналогична кривой охлаждения сплава а, за исключением температуры начала кристаллизации и длины горизонтального участка.
Определение теплоты плавления компонента на основании диаграммы состояния с эвтектикой
Ветви ликвидуса диаграммы состояния с эвтектикой (рис. 4. 3а) характеризуют равновесие насыщенных расплавов с соответствующими кристаллами чистого вещества, т. е показывают растворимость соответствующего компонента в расплаве при данной температуре.
Растворимость твердых веществ в жидкости для идеальных систем выражается уравнением Шредера:

| (4. 1) |
где: 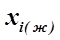 - мольная доля i -го компонента (растворителя) в жидком растворе;
- мольная доля i -го компонента (растворителя) в жидком растворе;
 - теплота плавления чистого компонента i;
- теплота плавления чистого компонента i;
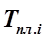 - температура плавления чистого компонента i;
- температура плавления чистого компонента i;
TL - температура начала кристаллизации раствора или температура, при которой насыщенный раствор и кристаллы чистого i -го компонента находятся в равновесии.
Данное уравнение справедливо для понижения температуры замерзания идеальных растворов, если в твердую фазу выделяется чистый растворитель, т. е. оно согласуется с данной диаграммой состояния.
|
|
|
Идеальными для рассматриваемой эвтектической системы можно принять растворы вблизи чистых компонентов, т. е. разбавленные.
Диаграмма состояния с эвтектикой позволяет по линии ликвидус определить состав насыщенного раствора ( 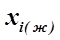 ) и температуру, при которой он находится в равновесии с кристаллами чистого растворителя ( TL ), а также температуру плавления чистого растворителя ( Тпл. i ). Подставляя эти данные в уравнение Шредера (4. 1), можно оценить теплоту плавления соответствующего растворителя
) и температуру, при которой он находится в равновесии с кристаллами чистого растворителя ( TL ), а также температуру плавления чистого растворителя ( Тпл. i ). Подставляя эти данные в уравнение Шредера (4. 1), можно оценить теплоту плавления соответствующего растворителя  .
.
Определение активности и коэффициента активности компонента на основании диаграммы состояния с эвтектикой
Расплавы данной системы в области средних концентраций не могут считаться идеальными и относятся к реальным. Для описания растворимости компонента в реальных растворах можно использовать понятие термодинамической активности компонентов и уравнение Шредера принимает вид:

| (4. 2) |
где: α i, - активность i -го компонента в реальном насыщенном растворе с концентрацией хi(ж), находящегося в равновесии с кристаллами чистого i -го компонента при температура TL;
Тпл i - температура плавления чистого компонента i.
Уравнение (4. 2) позволяет определить термодинамическую активность компонента, кристаллизующегося из раствора, если известна его теплота плавления 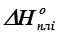 . Значения Tпл. i и TL для раствора с концентрацией хi(ж} определяются по диаграмме состояния.
. Значения Tпл. i и TL для раствора с концентрацией хi(ж} определяются по диаграмме состояния.
Зная активность компонента можно вычислить γ i -коэффициент активности i -го компонента в реальном растворе из уравнения:
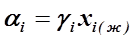
| (4. 3) |
|
|
|


