 |
4. Фазовые равновесия. в кристаллизующихся системах. Диаграммы плавкости. 4. 2. Основные типы диаграмм плавкости двухкомпонентных систем
|
|
|
|
4. ФАЗОВЫЕ РАВНОВЕСИЯ
В КРИСТАЛЛИЗУЮЩИХСЯ СИСТЕМАХ.
ДИАГРАММЫ ПЛАВКОСТИ
4. 1. Экспериментальный метод построения диаграмм плавкости. Термический анализ. Кривые охлаждения
Наиболее удобным экспериментальным методом для изучения фазового равновесия является метод термического анализа, который является частным случаем физико-химического анализа.
В основе метода термического анализа лежит экспериментальное установление температур фазовых переходов при медленном изменении температуры изучаемой системы данного состава. Так как любое фазовое превращение сопровождается тепловым эффектом, следовательно, равномерное изменение температуры системы в момент начала и окончания фазового перехода нарушается.
Наступление того или иного фазового превращения отмечается путем изучения площадок и перегибов на кривых зависимости температуры от времени, которые появляются вследствие выделения или поглощения теплоты фазового перехода. Предполагается, что нагрев или охлаждение производится при постоянном внешнем давлении ( р – const).
Графические зависимости изменения температуры системы с течением времени называются кривыми охлаждения, если со временем температура изучаемого образца понижается или кривыми нагревания, если температура повышается.
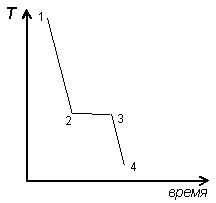
На рис. 4. 1. представлена кривая охлаждения чистого вещества, включающая процесс его кристаллизации.
Участок 1-2 этой кривой соответствует охлаждению жидкости ( К=1, Ф=1 ). По правилу фаз Гиббса для однокомпонентной системы с учетом одного внешнего параметра: С=1–Ф+1=1. С течением времени температура плавно уменьшается.
|
| Рис. 4. 1 Кривая охлаждения чистого вещества |
|
|
|
Горизонтальный участок 2-3 отвечает процессу кристаллизации. Система состоит из двух фаз: жидкости и кристаллов. В соответствии с правилом фаз данная система нонвариантна ( С=2–Ф= 0 ). Это теоретически обосновывает постоянство температуры кристаллизации чистого вещества, т. к. невозможно изменение никаких параметров без того, чтобы не уменьшилось количество фаз в системе. Несмотря на охлаждение системы, ее температура остается постоянной (за счет выделения теплоты кристаллизации), пока не исчезнет жидкая фаза.
Участок 3-4 характеризует плавное охлаждение кристаллической фазы, здесь так же Ф=1 и С = 1.
Отметим, что характер кривых охлаждения двухкомпонентных систем может быть несколько иным, но всегда при температуре фазового превращения, плавный ход такой кривой нарушается, т. к. любой переход связан с выделением или поглощением тепла. Это позволяет использовать кривые охлаждения, полученные для смесей разного состава изучаемой системы, для построения ее диаграммы состояния и анализа фазовых равновесий в ней.
В дальнейшем, при описании различных типов диаграмм состояния, мы будем показывать типичные для данной системы кривые охлаждения.
4. 2. Основные типы диаграмм плавкости двухкомпонентных систем
Диаграммы плавкости выражают зависимость температуры плавления (температуры равновесия между жидкой и твердой фазами) от состава системы, а также температуры твердофазных равновесий (полиморфные превращения, распад и образование твердых растворов) от состава системы.
Диаграммы состояния различаются в зависимости от характера взаимодействия компонентов, как в твердом, так и в жидком состоянии. В настоящем пособии рассматриваются диаграммы с неограниченной растворимостью компонентов в жидком состоянии, со следующим подразделением по характеру фаз в твердом состоянии:
|
|
|
1. Диаграмма состояния с неограниченной взаимной растворимостью компонентов (от А до В ) в твердом состоянии.
2. Диаграмма состояния с отсутствием взаимной растворимости компонентов А и В в твердом состоянии.
3. Диаграмма состояния с ограниченной взаимной растворимостью компонентов А и В в твердом состоянии.
4. Диаграмма состояния с устойчивым или конгруэнтно плавящимся промежуточным химическим соединением.
5. Диаграмма состояния с неустойчивым или инконгруэнтным промежуточным химическим соединением.
В каждой из этих групп можно выделить целый ряд характерных диаграмм, и некоторые из них принадлежат сразу к двум группам, т. к. в них образуются различные по природе твердые фазы, поэтому данная классификация условна. На простых типах диаграмм состояния рассмотрим основные методы их исследования.
|
|
|


