 |
7.3.2. Задачи для самостоятельной работы.
|
|
|
|
7. 3. 2. Задачи для самостоятельной работы.
Разбор типовой задачи.
Рассчитайте константу химического равновесия реакции гидролиза глицилглицина при 310°К, если DG° = -15, 1 кДж/моль. Обратима ли данная реакция практически?
Решение. Связь между Кравн. и DG° имеет вид DG°= –2, 3RTlgK.
lgK=  =
= 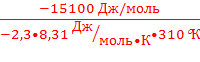 =2, 55
=2, 55
Кравн=102, 55=349
Реакция является практически обратимой, если 10-4< K< 104. В данном случае Кравн. попадает в этот интервал, значит реакция практически обратима.
2. Задачи для самостоятельной работы.
1. Какие воздействия на систему: 4НС1(г) + О2(г)« 2С12(г) + 2Н2О(г) (DНо< 0) приведут к смещению равновесия а) влево? б) вправо?
2. Стандартное изменение энергии Гиббса для реакции А + В « АВ при 298о К равно -8 кДж/моль. Начальные концентрации А и В равны 1 моль/л. Какова величина константы равновесия реакции.
3. Найти константу равновесия реакции N2O4« 2NO2, если начальная концентрация N2O4 составляла 0, 08 моль/л, а к моменту наступления равновесия распалась 50% N2O4.
4. Константа равновесия реакции гидратации сывороточного альбумина при 298о К равна 1, 19. Вычислите значение стандартной энтропии процесса, если известно, чтоDНо=-6, 08 кДж/моль.
5. Для некоторой реакции при 227о СDНо=-50 кДж/моль, а DSо=-100 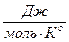 . Вычислите константу равновесия реакции при указанной температуре.
. Вычислите константу равновесия реакции при указанной температуре.
6. Для реакции 2NO2«N2O4 константа равновесия при 298о К равна 216. Рассчитайте константу равновесия при 46о С. Стандартная энтальпия реакции равна -57, 4 кДж/моль. ЗависимостьюDНоот Т пренебречь.
7. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310о К для реакции: АТФ + АМФ « 2АДФ, DGо=-2, 1 кДж/моль.
8. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 298о К для реакции (DGо=+29, 33 кДж/моль): креатин + фосфат « креатинфосфат + Н2О.
|
|
|
7. 4. Контроль усвоения темы занятия
Образец билета выходного контроля
1. Закон, определяющий соотношение между равновесными концентрациями, называется:
А. Законом сохранения масс Б. Законом Рауля
В. Законом действующих масс Г. Законом Вант-Гоффа
2. При каком соотношении ∆ Н и Т× ∆ Sсистема находится в равновесии:
А. ∆ Н = -Т× ∆ S Б. ∆ Н > -Т× ∆ S
В. ∆ Н < -Т× ∆ S Г. ∆ Н =Т× ∆ S
3. Влияние различных факторов на химическое равновесие определяет:
А. принцип Ле-Шателье Б. константа химического равновесия
В. закон действующих масс Г. закон Вант-Гоффа
4. Стационарное состояние для живого организма характеризуется: а) равенством скоростей прямой и обратной реакций; б) отсутствием изменений параметров и функций состояния систем; в) постоянством скорости поступления и удаления веществ и энергии; г) постоянством скорости изменения параметров и функций состоянием систем.
А. в, г Б. а, в В. б, г Г. а, б
5. Для открытых систем стационарное состояние характеризуется приростом энтропии в единицу времени, которое:
А. ∆ S/∆ t=0 Б. ∆ S/∆ t> 0 В. ∆ S/∆ t< 0 Г. ∆ S/∆ t®0
7. 5. Подведение итогов занятия.
7. 6. Задание на дом: Химическая кинетика.
Место проведения самоподготовки: читальный зал и др.
Литература: [1], [2], [3].
Занятие № 9
Тема: Химическая кинетика.
1. Актуальность темы. В живых организмах протекает множество разнообразных реакций, причем скорости их сбалансированы, что обеспечивает стационарное состояние. Изменение скорости какой либо реакции, обусловленное воздействием факторов окружающей среды или особенностями развития организма, может быть причиной развития патологии. Например, «молекулярные болезни» развиваются вследствие недостаточности синтеза ферментов. В результате этого резко замедляются или полностью блокируются важные метаболические реакции. При блокаде превращения фенилаланина возникает фенилкетонурия – тяжелое отставание в умственном развитии; при нарушении превращения диоксифенилаланина в меланин – альбинизм и т. д.
|
|
|
Изменение скоростей биохимических реакций лежат в основе регуляции метаболизма. Корректировка биохимических процессов также связана в большинстве случаев с регуляцией скоростей биохимических реакций. Физиотерапевтические методы основаны на изменении условий протекания реакций, а фармакотерапевтические методы – на введении веществ, являющихся модуляторами активности ферментов, самих ферментов и их коферментов, а также ингибиторов.
Важность применения кинетических положений в медицине подтверждается интенсивным развитием хемобиокинетики, изучающей скорость протекания различных этапов превращения эндогенных и экзогенных веществ в организме. Хемобиокинетика включает в себя фармакокинетику (превращение лекарств в организме) и биокинетику (превращение эндогенных веществ).
Кинетические исследования широко используются в диагностике различных патологических состояний.
2. Учебные цели: ознакомиться с расчетами скорости, порядка реакций, периода полупревращения, энергии активации химических реакций и изменением скорости реакции при изменении концентрации реагирующих веществ и температуры.
Для формирования профессиональных навыков обучающийся должен
знать:
-понятие скорости реакции и ее зависимость от различных факторов
-химическую сущность процессов, происходящих в живом организме с точки зрения их скоростей и влияние ферментов
уметь:
-пользоваться химическим оборудованием и реактивами
-производить расчеты по результатам эксперимента
владеть:
-самостоятельной работой с учебной и справочной литературой
-навыками безопасной работы в химической лаборатории и умение обращаться с химической посудой и реактивами
|
|
|
|
|
|


