 |
3. Материалы для самоподготовки к усвоению данной темы.
|
|
|
|
3. Материалы для самоподготовки к усвоению данной темы.
Вопросы для самоподготовки к занятию.
1. Что такое скорость химической реакции, и какие виды ее бывают? Как они обозначаются? Единица измерения скорости реакции?
2. Как подразделяются по механизму химические реакции? Приведите примеры каждого типа реакции. К какому типу относятся биохимические реакции?
3. Чем определяется скорость сложных реакций? Что такое лимитирующая стадия? Элементарный акт?
4. Как зависит скорость реакции от концентрации реагирующих веществ? Когда справедлив закон действующих масс в химической кинетике?
5. Что такое константа скорости реакции и каков ее физический смысл? От каких факторов она зависит?
6. Что такое порядок и молекулярность химической реакции? Когда численно они совпадают? Какие по порядку бывают реакции? Какие помолекулярности бывают реакции?
7. Приведите кинетические уравнения реакций в дифференциальной и интегральной формах для реакций нулевого, I- и II-го порядков.
8. Что такое период полупревращения? Как он рассчитывается для реакцийнулевого, I- и II-го порядков?
9. Как зависит скорость реакций от температуры? Для каких реакций применимо правило Вант-Гоффа? Что такое температурный коэффициент скорости реакции?
10. Приведите уравнение Аррениуса. Что такое энергетический профиль реакции? Энергия активации? Какова единица измерения ее? В каких пределах меняется энергия активации химических реакций?
11. На какие вопросы позволяют ответить в медицине кинетические расчеты?
12. Что такое катализ и катализаторы? Ферменты (энзимы), субстраты и интермедиаты? На каком принципе основано действие ферментов? Приведите и объясните уравнение Михаэлиса-Ментен.
|
|
|
4. Вид занятия: лабораторное занятие.
5. Продолжительность занятия: 3 академических часа.
6. Оснащение рабочего места.
6. 1. Дидактический материал: справочник физико-химических величин,
6. 2. ТСО: калькуляторы.
6. 3. Посуда и приборы: пробирки, мерные пробирки, секундомер, термометр, штатив для пробирок, водяная баня (на группу)
6. 4. Объекты исследования: растворы0, 1MNa2S2O3, 1MH2SO4- на группу.
6. 5. Реактивы: вода дистиллированная(на группу).
7. Содержание занятия.
7. 1. Образец билета входного контроля.
1. Что называют истинной (мгновенной) скоростью химической реакции?
1) количество вещества, прореагировавшего в единицу времени в единицеобъёма;
2) производная от концентрации реагирующего вещества по времени при постоянном объёме;
3) величина, пропорциональная произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам реакции;
4) изменение концентрации вещества за единицу времени в единицу объёма.
2. Единицы измерения скорости химической реакции:
1) моль/л·; 2) моль/л·с; 3) л·с/моль; 4) с-1.
3. Закон действующих масс устанавливает зависимость между скоростью химической реакции и:
1) температурой;
2) концентрацией реагирующих веществ;
3) массой реагирующих веществ;
4) количеством реагирующих веществ.
4. Сумму показателей степеней при концентрациях, входящих в кинетическое уравнение называют:
1) общим кинетическим порядком реакции;
2) молекулярностьюреакции;
3) порядком реакции по веществу;
4) стехиометрическими коэффициентами.
5. Что называется лимитирующей стадией сложной химической реакции?
1) самая быстрая стадия;
2) стадия, имеющая низкую энергию активации;
3) самая медленная стадия;
4) самая сложная стадия.
7. 2. Узловые вопросы необходимые для усвоения темы занятия.
|
|
|
1. Основные понятия химической кинетики.
2. Классификация реакций по механизму.
3. Зависимость скорости реакции от концентрации реагирующих веществ. Кинетические уравнения реакций.
4. Зависимость скорости реакции от температуры. Энергия активации.
5. Период полупревращения и его смысл.
6. Влияние на скорость реакции катализаторов. Ферменты и их роль в биохимических реакциях.
7. 3. Самостоятельная работа обучающихся
7. 3. 1. Лабораторная работа.
Задание 1. Изучение зависимости скорости реакции от концентрации.
Тиосульфат натрия разлагается в растворе серной кислоты по уравнению реакции:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S¯ + H2O.
Реакция состоит из следующих стадий:
 (очень быстро)
(очень быстро)
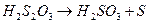 (медленно)
(медленно)
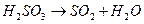 (быстро)
(быстро)
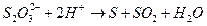
Скорость суммарного процесса определяется второй (медленной) стадией.
В 5 пробирок берут по 1, 2, 3, 4 и 5 мл 0, 1 М раствора Na2S2O3 и содержимое каждой пробирки доводят до 5 мл водой (добавляя в пробирки 4, 3, 2, 1 и 0 мл дистиллированной воды). Затем в полученные растворы тиосульфата натрия добавляют по 5 мл 1, 0 М раствора серной кислоты и сразу фиксируют время.
Когда в пробирке появляется помутнение (выделяется свободная сера) опять фиксируют время. Результаты измерений заносят в таблицу и рассчитывают условную скорость реакции. Так определяют время образования серы во всех пробирках последовательно, начиная с первой и заканчивая пятой пробиркой.
| Объем, мл | С | Время до появления мути, сек | Условная скорость Vусл = 1/t | ||
| Na2S2O3 | Н2О | Н2SO4 | |||
| 1, 0 | 4, 0 | 5, 0 | 0, 01 | ||
| 2, 0 | 3, 0 | 5, 0 | 0, 02 | ||
| 3, 0 | 2, 0 | 5, 0 | 0, 03 | ||
| 4, 0 | 1, 0 | 5, 0 | 0, 04 | ||
| 5, 0 | 0, 0 | 5, 0 | 0, 05 | ||
Постройте график зависимости скорости разложения Na2S2O3 от концентрации. Какой вывод можно сделать о порядке исследуемой реакции на основе полученной зависимости?
|
|
|



