 |
6. Оснащение рабочего места. 7. Содержание занятия. 7.1.Образец билета входного контроля. 7.2. Узловые вопросы, необходимые для усвоения темы занятия
|
|
|
|
6. Оснащение рабочего места
6. 1. Дидактический материал: справочник физико-химических величин
6. 2. ТСО: калькуляторы
6. 3. Посуда и приборы: бюретка на 25 мл, пробирки, стеклянная палочка, капельницы.
6. 4. Объекты исследования и реактивы: гидрозоль Fe(OH)3, растворы: 4М NaCl; 0, 01MNa2SO4; 0, 001MK3[Fe(CN)6]; 0, 1MHCl; дистиллированная вода, 10% аммиака, 0, 5 М FеС13 (на группу).
7. Содержание занятия
7. 1. Образец билета входного контроля
1. Размер частиц в коллоидных растворах:
1) менее 10-9м; 2) 10-9-10-7м;
3) более 10-7м; 4) 10-5-10-7м.
2. Переход нерастворимых в воде органических веществ в водную фазу в присутствии коллоидных ПАВ называется:
1) коагуляция; 2) адсорбция;
3) солюбилизация; 4) коллоидная защита.
3. Минимальная концентрация электролита, вызывающая коагуляцию золя:
1) коагулирующее действие 2) порог коагуляции
3) критическая концентрация мицелообразования 4) молярность
4. Коллоидные ПАВ:
1)NaCl; 2) C2H5OH; 3) мыло; 4) белки.
5. Ион, имеющий наибольшее коагулирующее действие к золю слюны: {mCa3(PO4)2·nHPO42-·(2n-x)Ca2+}2x-·хCa2+:
1) Na+; 2) Cl-; 3) Ca2+; 4) SO42-; 5) Fe3+.
7. 2. Узловые вопросы, необходимые для усвоения темы занятия
1) Какое явление называется коагуляцией? В чём выражаются признаки коагуляции?
2) Воздействием каких факторов можно вызвать коагуляцию лиофобных золей?
3) Что называют порогом коагуляции? В каких единицах выражается его величина?
4) Что такое коагулирующая способность электролита?
5) От каких факторов зависит коагулирующая способность электролита?
|
|
|
6) Как формулируется правило Шульце-Гарди?
7) Какое явление называют пептизацией?
8) Чем можно вызвать пептизацию осадка?
7. 3. Самостоятельная работа обучающихся
7. 3. 1. Лабораторная работа
Задание1. Определение порога коагуляции золя Fe(OH)3 различными электролитами и коагулирующего действия их.
В коническую колбу наливают 10 мл гидрозоля Fe(OH)3 и из бюретки титруют одним из электролитов до появления мути в колбе.
1) 4МNaCl; 2) 0, 01M Na2SO4; 3) 0, 001 M K3[Fe(CN)6].
Опыты выполняют поочередно, взяв каждый раз новую порцию гидрозоля Fe(OH)3. После каждого опыта бюретку промывают дистиллированной водой. Записывают объём электролита по показаниям бюретки, затраченного на коагуляцию золя. Порог коагуляции рассчитывают по формуле:
 (в ммоль/л);
(в ммоль/л);
а коагулирующее действие электролита КД =1/Спор, где и Сэл и Vэл – концентрация и объём каждого электролита, Vзоля – объём золя.
Результаты записывают в таблицу.
| Электролит | См, моль/л | Vэл, мл | Спор, ммоль/л | КД, л/ммоль |
| NaCl | ||||
| Na2SO4 | ||||
| K3[Fe(CN)6] |
Из полученных данных сделайте вывод о соответствии опытных данных с правилом Шульце-Гарди.
Задание 2. Проведение пептизации.
В пробирку наливают 5 мл раствора FeCl3и добавляют по каплям раствор аммимака до полного осаждения Fe(OH)3. Промывают полученный осадок декантацией: осадок заливают дистиллированной водой, перемешивают стеклянной палочкой и дают ему отстояться. Жидкость над осадком осторожно сливают так, чтобы осадок оставался в пробирке. К оставшемуся осадку снова приливают водуи декантацию повторяют до полного удаления аммиака. К промытому осадку прибавляют примерно 10 мл дистиллированной воды и перемешивают до получения взвеси, которую разливают приблизительно поровну на 3 пробирки. В первую пробирку добавляют 5-8 капель насыщенного раствора FeCl3, во вторую 10-15 капель раствора HCl. Третью пробирку оставляют для сравнения. Содержимое каждой пробирки тщательно перемешивают и через 10 минутпроводят наблюдение. Результаты наблюдений записывают в таблицу.
|
|
|
| № пробирки | Внешний вид содержимого пробирки | Добавленный электролит | Изменения, произошедшие в пробирке | Вид пептизации | Формулы мицелл |
По работе сделайте вывод.
7. 3. 2. Задачи для самостоятельной работы.
1. Разбор типовых задач.
1. Коагуляция 10 мл гидрозоля Fe(OH)3наступила при добавлении к нему 2 мл 0, 05 М раствора Na2SO4. Вычислить порог коагуляции и коагулирующее действие электролита.
Решение: Порог коагуляции рассчитывают по формуле:

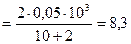 ммоль/л.
ммоль/л.
Коагулирующее действие равно: КД = 1/Спор = 1/8, 3 = 0, 12 л/ммоль.
2. Какие золи: гидроксида железа (III), иодида серебра (при избытке КJ), иодида серебра (при избытке AgNO3), следует смешать, чтобы произошла взаимная коагуляция?
Решение. Взаимная коагуляция золей возможна при смешении золей с противоположными знаками заряда гранул.
Гранулы золя Fe(OH)3 заряжены положительно. Гранулы золя AgJ (при избыткеAgNО3) тоже заряжены положительно, при избыткеKJ – отрицательно. Следовательно, взаимная коагуляция возможна при сливании золей: а) гидроксида железа (III) и иодида серебра (при избытке KJ) и б) иодида серебра (при избытке AgNO3) и иодида серебра (при избытке KJ).
|
|
|


