 |
Кислотно-основные каталитические реакции
|
|
|
|
ОСНОВЫ ТЕХНИЧЕСКОГО КАТАЛИЗА
1. Кислотно-основные каталитические реакции
2. Окислительно-восстановительные каталитические реакции
3. Основные каталитические процессы
4. Свойства карбкатионов
5. Нуклеофильный катализ
6. Металлокомплексный катаиз
7. Механизм и кинетика гетерогенно-каталитических реакций
8. Кислотно-основный гетерогенный катализ
9. Гетерогенный катализ на переходных металлах и их соединениях
10. Механизм каталитического крекинга
В зависимости от фазового состояния реагентов и катализатора катализ может быть гомо- и гетерогенным. Если реагенты и катализатор находятся в одной фазе (газовая смесь или раствор), то осуществляется гомогенный катализ. Если реагенты (газ или жидкость) плохо растворимы в жидком катализаторе имеются две фазы, то, хотя реакция осуществляется гомогенно, в одной из соприкасающихся фаз, она является гетерофазной. При гетерогенном катализе катализатор – твердое вещество, а реагенты – жидкие или газообразные вещества. Реакция в этом случае протекает на поверхности катализатора. Гетерогенный катализ распространен в нефтеперерабатывающей промышленности значительно шире, чем гомогенный.
С помощью гетерогенного катализа в промышленности основного органического и нефтехимического синтеза осуществляются процессы гидрирования и дегидрирования, многие реакции окисления, гидратации и дегидратации, алкилирования и т. д. Преимущества гетерогенного катализа перед гомогенным состоят в малом расходе катализатора на единицу количества продукта, в снижении или полном устранении токсичных сточных вод и расхода реагентов на промывку реакционной массы. Последнее обусловлено тем, что гетерогенный катализатор, находясь в твердом состоянии, легко отделяется от реакционной массы или вообще не уносится ею. Кроме того, в гетерогенном катализе нередко меньше коррозия аппаратуры, капитальные затраты и т. д.
|
|
|
Гомогенный катализ играет важную роль в технологии органического синтеза, особенно при жидкофазном хлорировании, алкилировании, окислении и при других многотоннажных процессах.
При большой эффективности гомогенному катализу присущи и недостатки: необходимость отделения (отмывки) катализатора от реакционной смеси, образование токсичных стоков, повышенный расход катализатора на единицу количества продукта, высокая стоимость, иногда коррозионная активность. В связи с этим намечается тенденция замены, где это возможно, гомогенных катализаторов на гетерогенные, а также их иммобилизация на твердых поверхностях.
По характеру химического взаимодействия катализатора с реагирующими веществами и промежуточных продуктов различают кислотно-основные и окислительно-восстановительные каталитические реакции и соответственно – катализаторы.
Кислотно-основные каталитические реакции
В кислотно-основных реакциях промежуточные активные частицы – ионы, катализатор инициирует их образование в результате передачи протонов от катализатора к реагенту или от реагента к катализатору. Катализаторами в этом случае являются кислоты (кислотный катализ) и основания (основной катализ).
В гомогенном катализе в качестве кислотных катализаторов в воде и водно-органических растворителях используются протонные кислоты (H2SO4, HCl, H3PO4 и др.), в неводных растворителях – апротонные кислоты (AlCl3, FeCl3 и др.) или сверхкислоты (кислота Льюиса HF – SbF5 наиболее сильная из всех известных кислот). В основном катализе применяются оксиды и гидроксиды щелочных металлов, третичные амины и т.д.
|
|
|
Как и в гомогенном катализе, кислотно-основный катализ на поверхности (гетерогенный) сводится к активированию реагента за счет кислотно-основного взаимодействия с кислотными или основными активными центрами поверхности.
Протонные (бренстедовские) и апротонные (льюисовские) активные центры имеются на ряде оксидных катализаторов (А12О3, SiO2), алюмосиликатах и цеолитах.
Кристаллическая решетка SiO2 состоит из соединенных вершинами тетраэдров. На ее поверхности находятся два типа групп: силоксановые  и силанольные
и силанольные  . Первые малоактивны, а вторые обладают определенной кислотностью и способны действовать как протонные кислоты.
. Первые малоактивны, а вторые обладают определенной кислотностью и способны действовать как протонные кислоты.
На g-Аl2Оз, часто используемом в качестве катализатора и носителя, имеется несколько типов ОН-групп, различающихся окружением и протонной кислотностью, а также льюисовские активные центры, представляющие собой ион алюминия А13+ с дефицитом электронов. При постепенном обезвоживании А12О3 во время прокаливания число протонных центров снижается, а льюисовских, наоборот, увеличивается.
Два упомянутых типа активных центров имеются и в алюмосиликатах, но протонные центры их обладают большей кислотностью, чем на А12Оз.
Цеолиты, используемые и как катализаторы, и как носители, отличаются высокой удельной поверхностью (400–800 м2/г) и особой структурой пор. Они являются алюмосиликатами обшей формулы (M2/nО) Al2О3 × MSiО2 × pH2О, где М – катион с зарядом n, М – модуль, равный мольному отношению SiO2 к Аl2Оз. Цеолиты обладают кислотными центрами Бренстеда и Льюиса.
Из природных и синтетических цеолитов особый интерес в качестве катализаторов представляют морденит (М=10), цеолиты типов А (М= 1,9 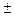 0,9), X (М = 2,5±0,5),
0,9), X (М = 2,5±0,5),
Y (М = 3,0–6,0). Основные элементы структуры цеолитов – тетраэдрические группировки SiO4 и АlО4, соединенные общими атомами кислорода. Цеолиты применяют в качестве катализаторов крекинга и изомеризации. В процессе нагревания цеолитов при 500-600 0С в основном образуются Бренстедовские кислотные центры, а при более высоких температурах растет концентрация льюисовских центров, а бренстедовских снижается.
Изменением модуля, введением разных катионов металлов (MgX более кислый, чем CaX) достигается широкое варьирование кислотности и каталитических свойств цеолитов. Например, искусственно созданный цеолит типа ZCM-5 обладает высокой кислотностью, а по реакционной способности с парафиновыми УВ его можно отнести к сверхкислотам.
|
|
|
Таким образом, на оксидных и солевых катализаторах кислотного типа имеются бренстедовские и льюисовские кислотные центры разной силы. Их кислотность можно определить титрованием кислотных центров катализатора основанием (бутиламином) в присутствии разных индикаторов, как это делается для гомогенных кислот-катализаторов. По изменению окраски индикатора судят о наличии и количестве активных центров разной кислотности.
Полученные этим методам экспериментальные данные показывают, что кислотные центры алюмосиликатов и цеолитов обладают очень высокой кислотностью, сравнимой с сильными неорганическими кислотами. Кислотность А12О3 как протонной кислоты оказывается значительно меньше.
|
|
|


