 |
Металлокомплексный катализ
|
|
|
|
Катализ органических реакций комплексами металлов является в настоящее время наиболее интенсивно и продуктивно развивающейся областью гомогенного катализа. Повышенный интерес к металлокомплексным катализаторам связан с высокой скоростью и селективностью вызываемых ими превращений, а также возможностью осуществлять новые реакции, трудно реализуемые другими методами.
Переходные металлы могут образовывать стабильные соединения с рядом органических молекул, свободных радикалов, ионов за счет того, что атом металла (комплексообразователь) является электроноакцептором, а органические молекулы, свободные радикалы и ионы представляют собой электронодоноры, их называют лигандами. Каталитические свойства комплексов переходных металлов обеспечиваются наличием близких по энергиям свободных nр- и частично заполненных ns- и (n—1) d-орбиталей. Эти девять валентных орбиталей могут участвовать в образовании связей практически с каждым элементом Периодической системы, что обеспечивает огромное многообразие лигандов. Число лигандов называют координационным числом. В комплексах металлов, катализирующих органические реакции, КЧ равно 4, 5, 6. Лиганды, связанные с центральным атомом или ионом, образуют внутреннюю координационную сферу комплексного соединения, которая может иметь заряд. Ионы, компенсирующие этот заряд образуют внешнюю сферу. Например, калий тетрахлоропалладат (II) - 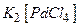 .
.
Электронная конфигурация и координационное число центрального атома, а также лигандное окружение определяет геометрию комплексного соединения (рисунок 4). Переходным металлам с КЧ 6 отвечают комплексы с октаэдрической конфигурацией (Сr(III), Pt (IV)), с КЧ 4 плоско-квадратной и тетраэдрической (Pt (II), Pd (II) и Ni (II), Cu (II) соответственно).
|
|
|
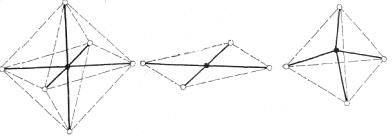
Рисунок 4 – Геометрия комплексных соединений
По типу связывания с металлом лиганды классифицируют как s- и p-лиганды.
s-Лиганды имеют одну (Н:-, Н3С:) или несколько неподеленных пар электронов, локализованных при одном донорном атоме (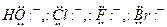 ). Одна пара электронов s-лиганда взаимодействует с вакантной гибридизованной орбиталью металла и образует s-связь.
). Одна пара электронов s-лиганда взаимодействует с вакантной гибридизованной орбиталью металла и образует s-связь.
Другая электронная пара образует p-связь (рисунок 5).
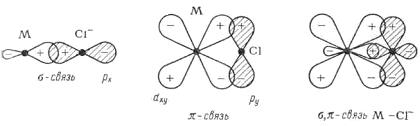
Рисунок 5 – Образование связей в комплексных соединений
В отличие от рассмотренных s-лигандов p-лиганды имеют донорные пары электронов, локализованные на двух и более центрах и представляющие собой p-электронные пары. Комплексы металлов с p-лигандами называют p-комплексами. К p-лигандам относятся соединения с двойной и тройной углерод-углеродными связями, производные ароматических соединений и др.
На рисунке 6
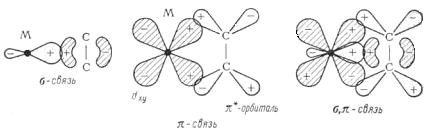
Рисунок 6 – Образование p -комплекса
показаны орбитали, участвующие в образовании связи олефина с металлом. s-связь с олефином образуется в результате взаимодействия пары p-электронов олефина со свободной гибридной орбиталью металла. Свободная пара d-электронов металла участвует в образовании p-связи, взаимодействуя со свободной антисвязывающей p-орбиталью олефина. Оба типа взаимодействия приводят к ослаблению связи С = С и увеличению реакционоспособности.
Реакции, катализируемые комплексами металлов, представляют собой последовательность элементарных стадий, включающих ввод реагента (или реагентов) в координационную сферу металла, превращение координированных молекул и регенерацию исходной формы каталитического комплекса. Эти стадии более многочисленны и разнообразны по сравнению с рассмотренными выше реакциями, протекающими при нуклеофильном, электрофильном и кислотно-основном катализе. Поэтому расшифровка механизма металлокомплексного катализа является обычно более сложной задачей. В качестве примера рассмотрим гомогенное гидрирование, механизм которого установлен с достаточной достоверностью.
|
|
|
В реакциях гидрирования проявляют каталитическую активность комплексы практически всех переходных металлов. Наиболее активные — комплексы металлов VIII группы, эффективно катализирующие присоединение водорода по кратным связям. Подбором лигандов и металла можно добиться высокой селективности гидрирования (С  С до С = С, диенов до олефинов и т. д.).
С до С = С, диенов до олефинов и т. д.).
Одним из распространенных катализаторов является комплекс Уилкинсона, который представляет собой квадратный d-комплекс родия Rh1[Р(С6Н5)з]зС1. Он переходит в активный при гидрировании комплекса за счет окислительного присоединения Н2 и отщепления одного из трифенилфосфиновых лигандов:
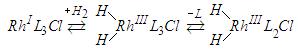
Затем следует каталитический цикл, включающий присоединение молекулы этилена, внедрение ее по связи Rh—Н, восстановительное элиминирование (присоединение гидрид-иона) и окислительное присоединение следующей молекулы водорода:
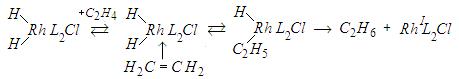
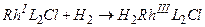
Лимитирующей является стадия внедрения олефина.
|
|
|


