 |
Основные каталитические процессы
|
|
|
|
Процессы гидрирования ароматических и ненасыщенных углеводородов являются важнейшими в многотоннажной органической технологии. Например, в мире производят бензол в количестве свыше 30 млн.т в год и около 20% идет на получение циклогексана (С6Н6 +3Н2→ С6Н12). Гидрирование обратимо и протекает с большим тепловым эффектом. Поэтому сдвигу равновесия вправо благоприятствует повышенное давление и умеренные температуры. Для проведения процесса используют металлические нанесенные катализаторы (Ni/Al2O3, Pt/Al2O3), процесс идет, как правило, в газовой фазе при температуре 150-200оС, давлении до 5 МПа в полочном реакторе с несколькими неподвижными слоями катализатора. Циклогексан окисляют в циклогексанон и адипиновую кислоту – исходные мономеры для производства полиэфирных волокон.
Гидроочистка нефтяных фракций является важнейшим каталитическим процессом в нефтепереработке и нефтехимии, на который приходится около 33% мировой первичной переработки нефти. Гидроочистка – каталитический процесс переработки нефтяного сырья под давлением водорода, предназначенный для гидрирования гетероатомных (S, N, O) органических и металлоорганических соединений, а также ненасыщенных и частично конденсированных ароматических углеводородов. При этом гетероатомы образуют молекулярные соединения в виде H2S, NH3, H2O. Олефины, диены, моно- и полициклические углеводороды переходят в насыщенные. В промышленности гидроочистке подвергают бензиновые фракции с целью подготовки для каталитического риформинга; керосиновые фракции с целью получения малосернистого реактивного топлива, осветительного керосина и растворителей и т.д. Гидроочистку проводят при температуре 320-420 оС, давлении 2,5-5 МПа, в присутствии алюмокобальтмолибденовых (АКМ) или алюмоникельмолибденовых (АНМ) катализаторов. Эти катализаторы содержат 10-19% МоО3 и 2-5% промоторов (СоО или NiО), нанесенных на оксид алюминия, который может быть модифицирован цеолитом или фтором.
|
|
|
Дегидрирование – химические процессы, протекающие с отщеплением атомов водорода от органического соединения. Обычно предназначено для получения непредельных соединений с одной или двумя двойными связями в молекуле. При этом обычно сохраняется первичное расположение атомов в цепи. Например, при каталитическом дегидрировании изобутана образуется изобутилен, который применяют для производства полиизобутилена – загущающая присадка к смазочным маслам, электроизоляционный материал, пропитка тканей и т.д. В настоящее время из изобутилена синтезируют (в реакции с метанолом) метил-трет-бутиловый эфир (МТБЭ) – высокооктановый компонент бензина:
 При дегидрировании используются алюмохромовые катализаторы (оксид хрома (III) нанесен на оксид алюминия и составляет от 10-20 до 40% масс. Промоторы – оксиды калия, магния, циркония и т.д. Для алюмохромового катализатора сильным каталитическим ядом является вода. Отравление водой обратимо и после ее удаления активность катализатора восстанавливается. Сернистые соединения также отравляют катализатор).
При дегидрировании используются алюмохромовые катализаторы (оксид хрома (III) нанесен на оксид алюминия и составляет от 10-20 до 40% масс. Промоторы – оксиды калия, магния, циркония и т.д. Для алюмохромового катализатора сильным каталитическим ядом является вода. Отравление водой обратимо и после ее удаления активность катализатора восстанавливается. Сернистые соединения также отравляют катализатор).
Изомеризация алканов служит для получения сырья промышленного органического синтеза, повышения октанового числа бензиновых фракций. Изомеризацией индивидуальных углеводородов бутана и пентана в промышленности получают соответственно изобутан и изопентан. Изобутан используется при алкилировании олефинов с целью получения алкилат-бензинов с высокими октановыми числами, а изопентан и изогексан – как компоненты автомобильного бензина. При дегидрировании изобутана и изопентана получают изобутилен и изопрен – исходные мономеры для получения различных полимерных материалов. Современные промышленные катализаторы парафиновых углеводородов являются бифункциональными системами, состоящих из металлов окислительно-восстановительного типа и носителя с кислотными свойствами. В качестве металлического компонента катализатора используются платина или палладий, носителя – фторированный или хлорированный оксид алюминия, алюмосиликаты. Высокотемпературная изомеризация проводится при 360-420 оС, под давлением водорода (для обеспечения постоянной скорости изомеризации) до 4 МПа на алюмоплатиновом катализаторе, промотированном фтором.
|
|
|
Риформинг – процесс, предназначенный для переработки бензиновых фракций (в основном прямогонных) под давлением водорода с целью получения высокооктановых автомобильных бензинов, ароматических углеводородов (бензола, толуола и др.) и водородсодержащего газа. Для получения автомобильных бензинов риформингу подвергаются бензиновые фракции, выкипающие в пределах 85-180 оС, бензола – 62-85 оС. Бензиновые фракции большинства нефтей содержат 60-70% парафиновых, 20-30% нафтеновых и 10-15% ароматических углеводородов. Октановые числа таких бензинов не превышают 40-50 ед. по моторным методам. Серу-, азот- и кислородсодержащие гетероатомные соединения способны дезактивировать катализатор риформинга. Сильным ядом для платины является оксид углерода. Металлоорганические соединения свинца, меди, мышьяка также являются каталитическими ядами. В блоке установки риформинга предусмотрена гидроочистка сырья от гетероатомных соединений. Процесс риформинга проводится при повышенных температуре (490-540 оС) идавлении водорода (0,35-3,0 МПа). Используют алюмоплатиновые катализаторы – металлическую платину, нанесенную на поверхность оксида алюминия и обработанную хлористыми или фтористыми соединениями (содержание платины от 0,36 до 0,62%, галогенидов от 0,7 до 1,75%). При риформинге парафиновые УВ подвергаются дегидрированию, изомеризации, дегидроциклизации и гидрокрекингу. По мере проведения процесса риформинга происходит дезактивация катализатора. Главная причина – образование кокса на активных центрах катализатора. Кокс откладывается в виде чешуек из 3-4 слоев диаметром 2,0-2,5 нм и толщиной 0,5-0,6 нм. Регенерация катализатора проводится выжиганием отложившегося кокса (который может составлять до 20% от массы катализатора) путем многостадийного окисления молекулярным кислородом. Для этого катализатор продуваю рециркулирующим газом, удаляя тяжелые углеводороды, затем поток водорода заменят на поток азота, при температуре около 250 оС добавляют небольшое количество кислорода (0,5-0,6% об.), затем при 300-400 оС доводят до 10% об. После выжигания катализатор хлорируют в среде воздуха, содержащего 0,4-0,5% об. хлора (CCl4). Это способствует уменьшению в катализаторе содержания свинца и др. металлов. В дальнейшем реактор продувается снова азотом, окисленную платину восстанавливают водородом до металла, и реактор вновь переключается на поток.
|
|
|
Свойства карбкатионов
В гомогенных каталитических реакциях, катализируемых кислотами и основаниями в сильно полярных средах (сульфолан, нитробензол) основными промежуточными частицами являются карбкатионы и карбанионы. Механизм реакции во многом определяется химическими свойствами этих частиц.
Карбкатионы – это органические ионы с положительным зарядом, локализованным на атоме углерода. Карбкатионы – высокоактивные частицы, вступающие в реакции с очень большой скоростью, сравнимой со скоростью радикалов.
Карбкатионы как промежуточные активные частицы играют важную роль в синтезе различных органических соединений. По карбкатионному механизму протекают также гетеролитические реакции каталитического крекинга, риформинга, изомеризации, алкилирования УВ и др.
Карбкатионы, как и радикалы, подвергаются мономолекулярному распаду и бимолекулярным реакциям замещения и присоединения. Существенное различие в химических свойствах карбкатионов и радикалов – способность первых с большой скоростью изомеризоваться.
Рассмотрим закономерности термохимии реакций карбкатионов:
Изомеризация
Изомеризация карбкатионов может проходить в результате переноса как гидрид-иона, так и карбаниона.
|
|
|
Перенос гидрид-иона, по-видимому, происходит по схеме:

т. е. происходит 1,2-изомеризация. Перенос метиланиона приводит к изомеризации углеродного скелета молекулы алкана:


Изомеризация первичного катиона во вторичный (Q = +79 кДж×моль-1), первичного в третичный (Q = +124) идет с выделением тепла.


Если углеродный скелет карбкатиона имеет первичные, вторичные и третичные углеродные атомы, то наиболее устойчива структура третичного иона.
Изомеризация углеродной цепи в результате переноса метиланиона связана с перехо-
дом вторичного карбкатиона в первичный (Q = -65) и поэтому эндотермична.

Следовательно, изомеризация углеродного скелета протекает значительно медленнее, чем первичного карбкатиона во вторичный и третичный и вторичного в третичный при переносе гидрид-иона.
С большой эндотермичностью (Q = -130) связано образование неопентильной структуры. Поэтому изомеризация углеродного скелета с образованием четвертичного атома углерода идет с малой скоростью.

Реакции же типа

экзотермичны примерно на 60 кДж-моль-1 и поэтому протекают со значительной скоростью.
Распад по связи С-С
Из данных термохимии распада карбкатионов видны следующие закономерности. Распад первичных ионов с неразветвленной углеродной цепью проходит тем легче, чем большее число атомов углерода содержит образующийся карбкатион. Отщепление метильного иона происходит значительно труднее, чем ионов с большим числом атомов углерода.
 (-275)
(-275)
 (-124)
(-124)
Распад вторичных ионов с образованием таких же ионов, как при распаде первичных, значительно эндотермичнее, вторичные карбкатионы устойчивее первичных в реакциях распада. С возрастанием числа атомов углерода в отщепляемом ионе теплота реакции снижается, однако для ионов с неразветвленной углеродной цепью во всех случаях эндотермичность распада велика.
 (-348)
(-348)
 (-310)
(-310)
 (-169)
(-169)
Третичные ионы устойчивее относительно распада, чем вторичные.
 (-408)
(-408)
Эндотермичность распада значительно снижается, когда отщепляется вторичный ион, и еще в большей степени – при отщеплении третичного иона. Распад первичных карбкатионов в этом случае становится экзотермичным.
 (+13)
(+13)
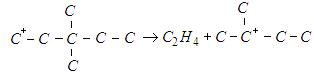 (+84)
(+84)
 (-8)
(-8)
Сопоставление энергетики распада и изомеризации карбкатионов показывает, что изомеризация должна предшествовать в большинстве случаев распаду. Устойчивость относительно распада третичных карбкатионов и их преимущественное образование при распаде больших карбкатионов должны приводить к образованию в основном изоструктур при распаде неразветвленных алкильных карбкатионов с большим числом атомов углерода. Очевидно, что при присоединена карбкатионов к алкенам по p-связи– процессе, обратном распаду, – характер изменения теплового эффекта противоположен. При присоединении данного иона к молекуле алкена тепловой эффект возрастает в ряду
|
|
|
 <
<  <
<  <
< 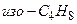
различие в тепловом эффекте настолько велико, что скорость реакции не может не увеличиваться.
Отрыв гидрид-иона
Стабилизация карбкатиона в соответствующий углеводород при отрыве от молекулы углеводорода гидрид-иона происходит легко, когда донором гидрид-иона является третичный атом углерода и атом углерода, сопряженный с p-связью или ареновым кольцом. Активность карбкатионов в этой реакции снижается в ряду:
 >
>  >
> 
 (-106)
(-106)
 (-73)
(-73)
 (-39)
(-39)
 (-89)
(-89)
 (-13)
(-13)
Передача протона
Передача протона молекуле алкена идет также для первичных ионов легче, чем для вторичных, и для вторичных легче, чем для третичных. Наиболее энергетически выгодна передача протона в том случае, когда образующийся ион - третичный.
 (+61)
(+61)
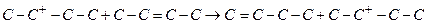 (-8)
(-8)
 (-51)
(-51)
 (+113)
(+113)
Все карбкатионные реакции всегда протекают или в жидкой фазе или на поверхности твердого катализатора.
Нуклеофильный катализ
Это катализ основаниями. Наиболее распространенными нуклеофильными катализаторами являются ионы галогенов 1-, Вr- и F-, оксианионы НСО-3, РО3-4 и НО-, амины R3N, R2NH, RNH2, и некоторые другие анионы. Нуклеофильные катализаторы ускоряют реакции замещения и присоединения.
1. В реакциях нуклеофильного присоединения YH по кратным связям роль

нуклеофильного катализатора часто выполняет анион Y-— сопряженное основание реагента, который обладает значительно более сильными нуклеофильными свойствами, чем YH, и легко присоединяется по кратной связи:
Y– + X=Z↔Y–X–Z–
Образующийся промежуточный анион регенерирует затем катализатор по протолитической реакции с YH:

По такой схеме происходит нуклеофильное присоединение по карбонильной группе реагента с кислотными свойствами, например синильной кислоты:

2. Замещение RZ + Y  RY + Z при нуклеофильном катализе в простейшем случае представляет собой чередование двух реакций нуклеофильного замещения:
RY + Z при нуклеофильном катализе в простейшем случае представляет собой чередование двух реакций нуклеофильного замещения:


В реакциях замещения, протекающих при насыщенном атоме углерода, свойствами активного нуклеофила и одновременно легко замещаемой группы обладают анионы иода и брома. Примером могут служить реакции гидролиза хлор- или бромпроизводных при катализе анионом иода:
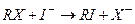

Общим для всех реакций является влияние растворителя на активность нуклеофильного катализатора, который в большинстве случаев представляет собой ионную пару M+Y-. Максимальная скорость реакций с участием M+Y- достигается в полярных апротонных растворителях (диметилсульфоксид  , ацетонитрил
, ацетонитрил  ), в которых соль диссоциирует, а свободный анион Y- практически не взаимодействует с растворителем.
), в которых соль диссоциирует, а свободный анион Y- практически не взаимодействует с растворителем.
Переход к протонным растворителям той же полярности (вода, метанол, этанол) снижает нуклеофильную активность свободного Y- на 2—5 порядков за счет специфической сольватации с образованием водородных связей [Y-… (HOR)n]. При этом сильнее сольватируются ионы, меньшие по размеру и с большим зарядом.
В растворителях умеренной полярности (высшие спирты, ацетон) равновесие диссоциации M+Y- ↔ M+ + Y - сдвинуто в сторону образования ионной пары. Ассоциация аниона Y- с катионом уменьшает нуклеофильную активность аниона так же, как и специфическая сольватация за счет водородной связи. Особенно прочные ионные пары образуются ионами небольшого размера, поэтому увеличение размеров катиона всегда способствует росту нуклеофильности аниона, что следует иметь в виду при выборе катализатора.
Так для придания растворимости анионам в малополярных растворителях нуклеофильные катализаторы применяют в виде солей с объемистыми органическими катионами  или добавляют специальные комплексообразователи для неорганического катиона.
или добавляют специальные комплексообразователи для неорганического катиона.
|
|
|


