 |
Первый закон термодинамики
|
|
|
|
Первый закон термодинамики является частным случаем закона сохранения и превращения энергии, впервые установленного основоположником русской науки М. В. Ломоносовым в замечательной по своей широте и значению формулировке закона сохранения и неуничтожаемости материи, движения и силы.
Первый закон термодинамики устанавливает эквивалентность при. взаимных превращениях механической и тепловой энергии и математически может быть выражен следующим образом:
Q = L,
где Q — количество теплоты, превращенной в работу;
L – работа, полученная за счет теплоты Q
Количества теплоты Q и работы L измерены в данном случае в соответствии с системой единиц СИ — в одних и тех же единицах — в джоулях.
Так как за единицу работы принят Дж, то единицей мощности будет являться Дж/с. Эта единица носит название ватт (Вт). В технике применяют более крупные единицы энергии (работы), и мощности: килоджоуль (кДж), мегаджоуль (МДж), киловатт (кВт), мегаватт (МВт), киловатт-час (кВт*ч).
В промышленности до последнего времени за единицу тепловой энергии принимали калорию (кал), за единицу механической работы килограмм-силу-метр, или килограммометр (кгс*м), а за единицу мощности - -килограммометр в секунду (кгс*м/с). Так как эти единицы слишком малы, то в качестве практических единиц были приняты килокалория (ккал), мегакалория (Мкал), лошадиная сила (л.с.) и киловатт (кВт). Соответствующими единицами работы (энергии) были приняты киловатт-час
(кВт*ч), лошадиная сила-час (л. с. ч.), а мощности — килограммометр в секунду (кгс*м/с).
Соотношения между различными единицами энергии и мощности даны соответственно в таблице 7 и 8.
Таблица 7 – Соотношения между единицами энергии
|
|
|
| Единицы измерения | Дж | кгс*м | кал | ккал | кВт*ч | ft*ibf |
| Джоуль | 0,102 | 0,239 | 2,39*10-4 | 2,78*10-7 | 0,7376 | |
| Килограм-сила*метр | 9,8067 | 2,343 | 2,343*10-3 | 2,72*10-6 | 7,233 | |
| Калория | 4,1868 | 0,42686 | 10- | 1,16*10 | 3,088 | |
| Килокалория | 4,1868*103 | 4,2686*102 | 103 | 1,16*10 | 3,088*103 | |
| Киловатт*час | 3,6*106 | 3,67*105 | 8,6*105 | 8,6*102 | 2,653*106 | |
| Фут-фунт-сила | 1,356 | 0,138 | 0,325 | 3,25*10-4 | 3,76*10-7 |
Таблица 8 – Соотношения между единицами мощности
| Единицы измерения | Вт | кгс*м/с | кал/с | ft*ibf/s | л.с. |
| Ватт | 0,102 | 0,239 | 0,7376 | 1,36*10-3 | |
| Килограмм-сила*метр в секунду | 9,8067 | 2,343 | 7,233 | 1,33*10-2 | |
| Калория в секунду | 4,1868 | 0,427 | 3,088 | 5,69*10-3 | |
| Фунт-фут-сила в секунду | 1,3558 | 0,138 | 0,3246 | 1,84*10-8 | |
| Лошадиная сила | 175,5 | 542,5 |
Пользуясь первым законом термодинамики, можно определить коэффициент полезного действия (к. п. д.) теплосиловых установок ηcт, характеризующий степень совершенства превращения ими теплоты в работу.
Кпд может быть вычислен, если известны расход топлива на 1 кВт*ч и теплота сгорания топлива, т. е. то количество теплоты, которое выделяется при полном сгорании массовой или объемной единицы топлива.
Если расход топлива на 1 кВт*ч (удельный расход топлива) b выражен в кг/(кВт*ч), а теплота сгорания топлива Qнр — в кДж/кг, то кпд теплосиловой установки
ηcт = 3600/ Qнр b (50)
Аналитическое выражение первого закона термодинамики или основное уравнение теплоты в дифференциальной форме Для любого тела
dQ = dU + dL (51)
где dQ—количество теплоты, сообщенное извне рабочему телу массой М кг;
dU — изменение внутренней энергии рабочего тела Дж;
dL — работа, совершенная рабочим телом по преодолению внешнего давления, «внешняя работа» расширения Дж.
Каждый из трех членов этого уравнения может быть в зависимости от характера изменения состояния положительным, или отрицательным, или равным нулю.
Для бесконечно малого изменения состояния 1 кг любого газа уравнение (51) примет следующий вид:
|
|
|
dq = du + dl. (52)
Так как
dl = pdv, то
dq = du +pdv. (53)
Для конечного изменения состояния уравнения (51) и (52) соответственно имеют вид
Q = ΔU+L (54)
ϥ = Δи +l (55)
Работа расширения 1 кг газа
dl = pdv;
l = 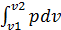 (56)
(56)
Изменение внутренней энергии идеального газа для любого процесса при бесконечно малом изменении состояния (для 1 кг)
В теплотехнических расчетах обычно требуется знать изменение внутренней энергии Δи, а не ее абсолютное значение; поэтому начало отсчета (О К или 0° С) для конечного результата (Δи) не имеет значения.
Интегрируя уравнение (56) в пределах ti — t2, получаем
Δи = cvm (t2 – t1) (57)
Где cvm— средняя массовая теплоемкость при постоянном объеме в пределах t1 — t2. Таким образом, изменение внутренней энергии идеального газа для любого процесса равно произведению средней теплоемкости при постоянном объеме на разность температур газа.
Энтальпия газов
Заменяя в основном уравнении первого закона dq = du + pdv
величину pdv через d (pv)— vdp, получаем
dq = du + d (pv) — vdp = d (u + pv) — vdp.
Выражение и + pv является параметром состояния. В технической термодинамике этот параметр называют антальпией и обозначают буквой i. Таким образом,
i = и + pv (58)
и, следовательно, основное, уравнение первого закона, выраженное через энтальпию, имеет вид
dq = di - vdp. (59)
Для идеальных газов
di = cd dT.
Следовательно,
i= 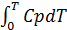 = CpmT, (60)
= CpmT, (60)
где Срт — средняя массовая теплоемкость при постоянном давлении в пределах от 0 до Т.
В теплотехнических расчетах обычно требуется знать изменение энтальпии, а не ее абсолютное значение, поэтому начало отсчета (0 К или 0° С) для конечного результата (Δi) не имеет значения.
Интегрируя уравнение (59) при р = const, получаем
Ϥp = i2 – i1 (61)
Таким образом, количество теплоты в процессе р = const численно можно найти как разность энтальпии конечного и начального состояния.
Cмешение газов
При смешении химически невзаимодействующих газов, имеющих различные давления и температуры, обычно приходится определять конечное состояние смеси. При этом различают два случая.
1. Смешение газов при V = const. Если суммарный объем, занимаемый газами до и после смешения, остается неизменным и газы до смешения занимают объемы V1, V2,.....Vп м3 при давлениях p1, р2,. рп и температурах T1, Т2,..., Тп, а отношения теплоемкостей этих газов cp/cv равны k1 k2.....kn, то параметры смеси определяют по формулам;
|
|
|
Температура
T = 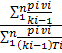 … (62)
… (62)
Давление
P = 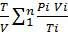 .. (63)
.. (63)
Объем
V = 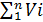
Для газов, у которых мольные теплоемкости равны, а следовательно, равны и значения k, формулы (62) и (63) принимают вид
T = 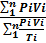 .. (64)
.. (64)
Р = 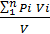 (65)
(65)
2. Смешение газовых потоков. Если массовые расходы смешивающихся потоков равны M1, М2, …..Mn кг/ч, объемные расходы— V1, V2,.... Vn м3/ч, давления газов — P1, р2, Pn, температуры— Т1, Т2……Тn, а отношения теплоемкостей отдельных газов равны соответственно k1, k2,..., kn, то температуры смеси определяют по формуле
Т = 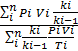 (66)
(66)
Объемный расход смеси в единицу времени при температуре Т и давлении р
V = 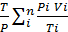 .. (67)
.. (67)
Для газов, у которых значения k равны, температуру смеси определяют по формуле (64). Если газовые потоки, помимо одинаковых значений k, имеют также равные давления, то формулы (66) и (67) принимают вид
Т = 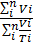 .. (68)
.. (68)
V = T 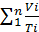 .. (69)
.. (69)
Все уравнения, относящиеся к смешению газов, выведены при условии отсутствия теплообмена с окружающей средой.
Примеры решения задач
1. В котельной электрической станции за 20 ч работы сожжены 62 т каменного угля, имеющего теплоту сгорания 28 900 кДж/кг.
Определить среднюю мощность станции, если в электрическую энергию превращено 18% теплоты, полученной при сгорании угля.
Реше н и е:
Количество теплоты, превращенной в электрическую энергию за 20 ч работы,.
Q = 62*1000 *28 900*0,18 кДж.
Эквивалентная ему электрическая энергия или работа,
L = 62*1000*28900 *0,18/ 3600 = 89 590 кВт*ч.
Следовательно, средняя электрическая мощность станции
N = 89 590/20 = 4479 кВт.
Ответ: N = 4479 кВт
2. Паросиловая установка мощностью 4200 кВт имеет кпд ηст= 0,20.
Определить часовой расход топлива, если его теплота сгорания Qнр = 25 000 кДж/кг.
Ре ш е н ие:
Из формулы (50)
b = 3600/ ηст Qнр = 3600/0,2* 25 000 = 0,72 кг/(кВт*ч)
Тогда часовой расход топлива составит τ =0,72*4200 = 3024 кг/ч.
Ответ: τ = 3024 кг/ч.
3. Найти изменение внутренней энергии 1 кг воздуха при переходе его от начального состояния t1= 300° С до конечного при t2 = 50° С. Зависимость теплоемкости от температуры принять линейной. Ответ дать в кДж.
|
|
|
Решение:
Изменение внутренней энергии найдем по формуле (57):
Δи = cvm (t2 – t1)
Пользуясь таблицей 3, получим для воздуха
(cVm)0t = 0,7084 + 0,00009349/кДж/(кг*К);
(cVm)50300= 0,7084 + 0,00009349(50 + 300) = 0,7411 кДж/(кг*К).
Следовательно,
Δи = 0,7411 (50 — 300) = -185,3 кДж/кг.
Ответ: Δи = -185,3 кДж/кг.
4 В двух разобщенных между собой сосудах А и В (рисунок 8) содержатся следующие газы: в сосуде А — 50 л азота при давлении р1 = 2 МПа и температуре t1 = 200° С, в сосуде В — 200 л углекислого газа при давлении р2 = 0,5 МПа и температуре t2 = 600° С.
Определить давление и температуру, которые установятся после соединения сосудов. Теплообменом с окружающей средой пренебречь.
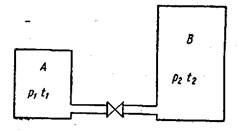
Рисунок 8 – Разобщенные сосуды, соединенные между собой
Решение
Температуру смеси определяем по формуле (62)
T = 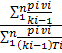
Значения k для азота и углекислоты находим из таблицы 3 и 4:
kN2 = Cp200/Cv200 = 29,471/21,156 = 1,39
kCO2 = Cp600/Cv600 = 52,452/44,137 = 1,19
Следовательно,
Т = 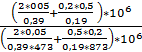 =
= 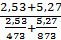 =
= 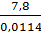 = 684 К = 4110С
= 684 К = 4110С
Давление смеси получим, пользуясь формулой (63):
P = 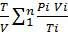 =
= 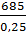 (
(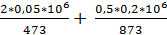 ) =
) = 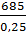 (21,1 + 11,4) = 0,89 МПа
(21,1 + 11,4) = 0,89 МПа
Ответ: Т = 684 К = 4110С; Р = 0,89 МПа
|
|
|


