 |
Краткие теоретические сведения
|
|
|
|
Основные формулы и уравнения
Состав газовой, смеси определяется количеством каждого из газов, входящих в смесь, и может быть задан массовыми или объемными долями.
Массовая доля определяется отношением массы отдельного газа, входящего в смесь, к массе всей смеси:
m1 = M1/M, m2 = M2/M, m3 = M3/M,………., mn = Mn/M
где M1, М2,Мз,..., Мп — массы отдельных газов;
М - масса всей смеси.
Объемной долей газа называют отношение объема каждого компонента, входящего в смесь, к объему всей газовой смеси при условии, что объем каждого компонента отнесен к давлению и температуре смеси (приведенный объем):
r1= V1/V, r2 = V2/V, r3 = V3/V, ………….., rn = Vn/V
где V1, V2, V3,..., Vn - приведенные объемы компонентов газов, входящих в смесь;
V- общий объем газовой смеси.
Очевидно, что
M1+M2+M3+……….+Мn = M
M1+m2+m3+………..+mn = 1
а также
V1+V2+V3+………..+Vn = V;
r1+r2+r3+…………..+rn = 1
Для перевода массовых долей в объемные пользуются формулой
ri = 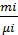 ∕
∕  (24)
(24)
Объемные доли переводят в массовые по формуле
mi = ri*μi ∕ 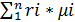 (25)
(25)
Плотность смеси определяют из выражения
ρсм =  …… (26)
…… (26)
если известен массовый состав, по формуле
ρсм =  ……… (27)
……… (27)
Удельный объем смеси представляет величину, обратную ρсм; поэтому, если дан объемный состав смеси, то
Vсм =  ….. (28)
….. (28)
Если же известен массовый состав, то
Vсм =  …. (29)
…. (29)
Из уравнения (26) легко получить значение так называемой кажущейся молекулярной массы газовой смеси
μсм = 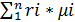 …. (30)
…. (30)
или через массовый состав
μсм =  ….. (31)
….. (31)
Газовую постоянную смеси газов (RCM) можно выразить или через газовые постоянные отдельных компонентов, входящих в смесь, или через кажущуюся молекулярную массу смеси
Rсм =  … (32)
… (32)
или
Rсм = 8314/μсм = 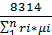 … (33)
… (33)
Связь между давлением газовой смеси и парциальными давлениями отдельных компонентов, входящих в смесь, устанавливается следующей зависимостью (закон Дальтона), легко получаемой из основного уравнения кинетической теории газов:
|
|
|
Р = Р1+Р2+Рз+………+Рn (34)
где- Р — общее давление газовой смеси;
P1,Р2,Р3,……..Рп — парциальные давления отдельных компонентов, входящих в смесь.
Парциальные давления определяются проще всего, если известны объемные доли отдельных компонентов, входящих в смесь;
Р1 = Рr1, P2 = Pr2 и т.д.
или вообще
Pi = Рri, (35)
где pi — парциальное давление любого газа, входящего в смесь.
Если известны массовые доли, то парциальное давление любого газа, входящего в смесь,
Pi = mi* Ri/Rсм*Р (36)
В таблице 3 даны формулы для расчета газовых смесей.
Таблица 3 – Формулы для расчета газовых смесей
| Задание состава смеси | Перевод из одного состава в другой | Плотность(кг/ м3) и удельный объем смеси(м3/кг) | Кажущаяся молекулярная масса смеси | Газовая постоянная смеси, (ДЖ/кг*К) | Парциальное давление, (Па) |
| Массовыми долями | ri= 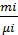 ∕ ∕ 
| Vсм =  ,
ρсм = ,
ρсм = 
|
μсм = 
|
Rсм= 
| Pi = mi* Ri/Rсм*Р |
| Объемными долями | mi = ri*μi ∕ 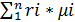
| rсм = 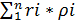 ,
vсм = ,
vсм = 
|
μсм= 
| Rсм= =8314/μсм = 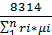
| Pi = Рri, |
Теплоемкостью называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1° С.
За единицу количества энергии в системе СИ применяют джоуль (Дж). В системе СИ джоуль является универсальной единицей, применяемой для измерения всех видов энергии: тепловой, механической, лучистой и пр. В качестве тепловой единицы 1 Дж представляет собой такое ее количество, которое появляется в результате превращения механической работы 1 Дж в теплоту. В качестве единицы механической энергии джоуль представляет собой работу, совершаемую силой, равной 1 ньютону при перемещении ею тела на расстояние 1 м в направлении действия силы (1 Дж = Н*м = 1 кг *м2/с2).
|
|
|
В зависимости от выбранной количественной единицы вещества различают мольную теплоемкость μс — кДж/(кмоль*К), массовую теплоемкость с — кДж/(кг*К) и объемную теплоемкость с' — кДж/(м3*К).
Как было указано выше, 1 м3 газа в зависимости от параметров его состояния имеет разные массы. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1м3 его при нормальных условиях [рн = 101 325 Па (760 мм рт. ст.) и Тн =273 К (tн = 0°С).
Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо из них. Удобнее всего иметь величину мольной теплоемкости. Тогда массовая теплоемкость
с = μс/μ (37)
а объемная теплоемкость
с' = μс/22,4 (38)
Объемная и массовая теплоемкости связаны между собой зависимостью
с' = сρн,
где ρн—плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По тому признаку различают среднюю и истинную теплоемкость.
Если q — количество теплоты, сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 (или, что то же, от Т1 до Т2), то
ст = q/t2-t1 (39)
представляет собой среднюю теплоемкость в пределах t1—t2. Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью. Аналитически последняя определяется как
c = dq /dt
Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса. Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления.
Для газов особо важное значение имеют следующие два случая нагревания (охлаждения):
1) изменение состояния при постоянном объеме;
2) изменение состояния при постоянном давлении/
Обоим этим случаям cоответствуют различные значения теплоемкостей.
Таким образом, различают истинную и среднюю теплоемкости:
а) мольную — при постоянном объеме (μсv и μсmv,) и постоянном давлении (μср и μсрm);
б) массовую - при постоянном объеме (cv и сvm) и постоянном давлении (ср срт);
в) объемную—при постоянном объеме (с'v и с′рт) и постоянном давлении (с'р и с′рт)
Между мольными теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость:
|
|
|
μср - μсv = μR = 8,314 кДж/(кмоль*К) (40)
Для приближенных расчетов при невысоких температурах можно принимать следующие значения мольных теплоемкостей (таблица 4).
Таблица 4 - Приближенные значения мольных теплоемкостей при постоянном объеме и постоянном давлении (с = const)
| Газы | Теплоемкость в кДж/(кмоль*К) | |
| μср | μсv | |
| Одноатомные Двухатомные Трех- и многоатомные | 12,56 20,93 29,31 | 20,93 29,31 37,68 |
В технической термодинамике большое значение имеет отношение теплоемкостей при постоянном давлении и постоянном объеме, обозначаемое буквой k:
k = μср/ μсv = ср/сv
Если принять теплоемкость величиной постоянной, то на основании данных таблицы 4 получаем: для одноатомных газов k = 1,67; для двухатомных газов k = 1,4; для трех- и многоатомных газов k =1,29.
Теплоемкость газов изменяется с изменением температуры, причем эта зависимость имеет криволинейный характер. В таблицах V—XII (смотри приложения учебного пособия О.М. Рабинович «Сборник задач по технической термодинамике» М., «Машиностроение», 2011,344с) приведены теплоемкости для наиболее часто встречающихся в теплотехнических расчетах двух- и трехатомных газов.
При пользовании таблицами значения истинных теплоемкостей, а также средних теплоемкостей в пределах от 0° до t берут непосредственно из этих таблиц, причем в необходимых случаях производится интерполирование.
Количество теплоты, которое необходимо затратить в процессе нагревания 1 кг газа в интервале температур от t1 до t2
q =(ст)׀t1t2 (t2 - t1) = cm2t2 – cm1t1 (41)
где cm1 и ст2 — соответственно средние теплоемкости в пределах 0° — t1 и 0° - t2.
Из формулы (41) легко получить выражения для определения количества теплоты, затрачиваемой в процессе при постоянном объеме и в процессе при постоянном давлении, т. е.
qv = cvm2t2 – cvm1t1 (42)
qp = cpm2t2 – cpm1t1 (43)
Если в процессе участвуют М кг или VH м3 газа, то:
Qv = М (cvm2t2 — cvm1t1) = Vн (cˊvm2t2 — c'vm1t1); (44)
Qp = М (cpm2t2 — cpm1t1) = Vн (cˊpm2t2 — c'pm1t1); (45)
Нелинейную зависимость истинной теплоемкости от температуры представляют обычно уравнением вида
|
|
|
с = a + bt+ dt2,
где а, b и d — величины, постоянные для данного газа.
Часто в теплотехнических расчетах нелинейную зависимость теплоемкости от температуры заменяют близкой к ней линейной зависимостью. В этом случае истинная теплоемкость
с = а + bt,
а средняя теплоемкость при изменении температуры от t1 доt2
cm = a+ b/2+(t1 + t2),
где а и b — постоянные для данного газа.
Для средней теплоемкости в пределах 0° — t эта формула принимает вид
cm = a+b/2t (46)
В таблице 5 приведены интерполяционные формулы для истинных и средних мольных теплоемкостей при постоянном давлении, а в таблице 6 — для средних массовых объемных теплоемкостей при постоянном объеме.
Таблица 5 - Интерполяционные формулы для истинных и средних мольных теплоемкостей газов при постоянном давлении
| Газ | Мольная теплоемкость при Р = const в Дж/(кмоль*К) | |||
| истинная | средняя | |||
| В пределах 0 – 10000С | ||||
| О2 | µcp = 29,5802 + 0,0069706t | µcpm =29,2080 + 0,0040717 t | ||
| N2 | µcp = 28,5372 +0,0053905 t | µcpm = 28,7340 + 0,0023488 t | ||
| CO | µcp = 28,7395 + 0,0058862 t | µcpm = 28,8563 + 0,0026608 t | ||
| Воздух | µcp = 287558 + 0,0057208 t | µcpm = 28,8270 + 0,0027080 t | ||
| Н2О | µcp = 32,8367 + 0,0116611 t | µcpm = 33,1494 + 0,0052749 t | ||
| SO2 | µcp = 42,8728 + 0,0132043 t | µcpm = 40,4386 + 0,0099562 t | ||
| В пределах 0 – 15000С | ||||
| H2 | µcp = 28,3446 + 0,0031518 t | µcpm = 28,7210 + 0,0012008 t | ||
| CO2 | µcp = 41,3597 + 0,0144985 t | µcpm = 38,3955 + 0,0105838 t | ||
| В пределах1000 – 27000С | ||||
| О2 | µcp = 33,8603 + 0,021951 t | µcpm = 31,5731 + 0,0017572 t | ||
| N2 | µcp = 32,7466 + 0,016517 t | µcpm = 29,7815 + 0,0016835 t | ||
| CO | µcp = 33,6991 + 0,0013406 t | µcpm = 30,4242 + 0,0015579 t | ||
| Воздух | µcp = 32,9534 + 0,0017806 t | µcpm = 30,1533 + 0,0016973 t | ||
| Н2О | µcp = 40,2393 + 0,0059854 t | µcpm =34,5118 + 0,0045979 t | ||
| В пределах1500 – 30000С | ||||
| H2 | µcp = 31,0079 + 0,0020243 t | µcpm = 28,6344 + 0,0014821 t | ||
| CO2 | µcp = 56,8768 + 0,0021738 t | µcpm = 48,4534 + 0,0030032 t | ||
Теплоемкость газовой смеси
массовая
cсм = 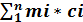 … (47)
… (47)
объемная
сˊсм = 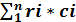 .. (48)
.. (48)
мольная
mссм =  .. (49)
.. (49)
Таблица 6 - Интерполяционные формулы для средних массовых и объемных теплоемкостей газов при постоянном объеме
| Газ | Теплоемкость в кДж/(кг*К) | |
| массовая | объемная | |
| В пределах 0 – 10000С | ||
| О2 | Cpm = 0,9127+0,00012724t | C΄pm = 1,3046+0,00018183t |
| Cvm = 0,6527 +0,0001272t | C΄vm = 0,9337 + 0,00018183t | |
| N2 | Cpm = 1,0258 + 0,00008382 t | C΄pm = 1,2833 + 0,00010492 t |
| Cvm= 0,7289 + 0,00008382 t | C΄vm = 0,9123 + 0,0000492 t | |
| CO | Cpm = 1,0304 + 0,00009875 t | C΄pm = 1,2883 +0,00011966 t |
| Cvm= 0,7335 + 0,00009575 t | C΄vm = 0,9173 + 0,00011966 t | |
| Воздух | Cpm = 0,9952 + 0,00009349 t | C΄pm = 1,2870 + 0,00012091 t |
| Cvm = 0,7084 + 0,00009349 t | C΄vm = 0,9161 + 0,00012091 t | |
| Н2О | Cpm = 1,8401 + 0,00029278 t | C΄pm = 1,4800 + 0,00023551 t |
| Cvm =1,3783 + 0,00029278 t | C΄vm = 1,1091 + 0,00023551 t | |
| SO2 | Cpm = 0,6314 + 0,00015541 t | C΄pm = 1,8472 + 0,00004547 t |
| Cvm = 0,5016 + 0,00015541 t | C΄vm = 1,4763 + 0,00004547 t | |
| В пределах 0 – 15000С | ||
| Н2 | Cpm = 14,2494 + 0,00059574 t | C΄pm = 1,2803 + 0,00005355 t |
| Cvm = 10,1241 + 0,00059574 t | C΄vm = 0,9094 + 0,00005355 t | |
| S2 | Cpm = 0,8725 + 0,00024053 t | C΄pm = 1,7250 + 0,00004756 t |
| Cvm = 0,6837 + 0,00024053 t | C΄vm = 1,3540 + 0,00004756 t |
Примеры решения задач
|
|
|
1. Определить объемный состав воздуха, его газовую постоянную, кажущуюся молекулярную массу и парциальные давления кислорода и азота, если давление воздуха по барометру В =101 325 Па.
Решение:
По уравнению (24) получаем
rO2 =  =
=  = 0,21
= 0,21
rN2 = 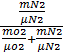 =
=  = 0,79
= 0,79
Газовую постоянную воздуха находим по уравнению (32)
Rсм=  = mO2*RO2 + mN2*RN2 = 0,232*260 + 0,768*295 = 287 Дж/(кг*К)
= mO2*RO2 + mN2*RN2 = 0,232*260 + 0,768*295 = 287 Дж/(кг*К)
Кажущуюся молекулярную массу смеси определяем из уравнения (30)
μсм = 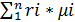 = rO2*μO2 + rN2*μN2 = 0,21*32 + 0,79*28,02 = 28,9
= rO2*μO2 + rN2*μN2 = 0,21*32 + 0,79*28,02 = 28,9
или из уравнения (33)
Rсм = 8314/μсм
Отсюда
μсм = 8314/Rсм = 8314/287 = 28,9
Парциальные давления получим из уравнения, (35)
Pi = Рri,
следовательно;
РО2 = rO2*P = 0,21*101 325 = 21 278 Па;
РN2 = rN2*P = 0,79*101 325 = 80 047 Па.
Ответ: rO2 = 0,21, rN2 = 0,79;
Rсм = 287 Дж/(кг*К);
μсм = 28,9;
РО2 = 21 278 Па;
РN2 =80 047 Па.
2.Смесь газов состоит из водорода и окиси углерода. Массовая доля водорода тн, = 0,67%.
Найти газовую постоянную смеси и ее удельный объем при нормальных условиях.
Решение:
Из уравнения (32)
Rсм =  = m1*R1 + m2*R2 = 0,0667*4124 + 0,9333*296,8 = 552 Дж/(кг*К).
= m1*R1 + m2*R2 = 0,0667*4124 + 0,9333*296,8 = 552 Дж/(кг*К).
Удельный объем газовой смеси получим из характериcтического уравнения
vн = RTн/Рн = 552*273/ 101325 = 1,49 м3/кг.
Ответ: Rсм = 552 Дж/(кг*К); vн = 1,49 м3/кг.
3.Найти объемную теплоемкость кислорода при постоянном объеме и постоянном давлении, считая с = const.
Решение:
По таблице 4 для двухатомных газов
mсv = 20,93 кДж/(кмоль*К);
mсp= 29,31 кДж/(кмоль*К).
Следовательно, для кислорода (и любого двухатомного газа)
сˊv = mсv/22,4 = 20,93/22,4 = 0,934 кДж/(м3*К)
сˊр = m сˊр /22,4 = 29,31/22,4 = 1,308 кДж/(м3*К).
4. Вычислить среднюю массовую и среднюю объемную теплоемкость окиси углерода при постоянном объеме для интервала температур 0—1200° С, если известно, что для окиси углерода (mсрm)1200 = 32,192 кДж/(кмоль*К).
Сопоставить полученные результаты с данными таблицы VII. (смотри приложения учебного пособия О.М. Рабинович «Сборник задач по технической термодинамике» М., «Машиностроение», 2011,344с)
Р е ше н и е:
На основании формул (37), (38) и (40) имеем
(mсрm)1200 = 32,192 — 8,314 = 23,877 кДж(кмоль.*К);
(cvm)1200= (mcv)1200 /28 = 23,877/28 = 0,8528 кДж/(кг*К);
(cˊvm)1200 = (mcv)1200/22,4 = 23,877/22,4 = 1,0659 кДж/(м3*К)
Из таблицы VII
(cvm)1200 = 0,8566 кДж/(кг*К); (cˊvm)1200 = 1,0651кДж/(м3*.К).
Ответ: (cvm)1200 = 0,8566 кДж/(кг*К); (cˊvm)1200 = 1,0651кДж/(м3*.К).
5.Вычислить среднюю теплоемкость срт для воздуха при постоянном давлении в пределах 200—800° С, считая зависимость теплоемкости от температуры нелинейной.
Решение:
По уравнениям (39) и (43)
(срm)t2t1 = срm2t2 - срm1t1/t2 – t1
Пользуясь таблицей XII, получим для воздуха
(срm)800=1,0710 кДж/(кг*К);
(срm)200= 1,0115 кДжДкг*К),
отсюда
(срm)800200 =1,0710*800— 1,0115*200/800-200 = 1,091 кДж/(кг*К).
Ответ: (срm)800200 = 1,091 кДж/(кг*К).
6.В закрытом сосуде объемом V = 300 л находится воздух при давлении р1 = 0,8 МПа и температуре t1= 20° С.
Какое количество теплоты необходимо подвести для того, чтобы температура воздуха поднялась до t2 = 120°С? Задачу решить, принимая теплоемкость воздуха постоянной, а также учитывая зависимость теплоемкости от температуры. Определить относительную ошибку, получаемую в первом случае.
Ре ш е н и е:
Пользуясь уравнением состояния, определяем массу воздуха, находящегося в сосуде:
M= Vp/RT = 0,3*106*0,3 / 287*293 = 1,07 кг
Для двухатомных газов, считая теплоемкость величиной постоянной, имеем
mсv = 20,93 кДж/(кмоль*К);
следовательно, теплоемкость воздуха
сv=mсv /m = 20,93/28,96 = 0,7226 кДж/(кг * К)
Количество подведенной теплоты
Q = Mcv (t2-t1) = 1,07*0,7227.100 = 77,3 кДж.
Теплоемкость воздуха с учетом ее зависимости от температуры определяем из таблицы XII(смотри приложения учебного пособия О.М. Рабинович «Сборник задач по технической термодинамике» М., «Машиностроение», 2011,344с)
Пользуясь интерполяцией, находим
сv = 0,7209 кДж/(кг*К).
Следовательно, относительная ошибка
0,7227 - 0,7209/0,7209 *100% = 0,25%
Незначительная величина ошибки объясняется малым интервалом температур. При большой разности температур относительная ошибка может достигнуть весьма большой величины.
Ответ: Q = 77,3 кДж
|
|
|


