 |
Второй закон термодинамики
|
|
|
|
Второй закон термодинамики определяет направление, в котором протекают процессы, устанавливает условия преобразования тепловой энергии в механическую, а также определяет максимальное значение работы, которая может быть произведена тепловым двигателем.
Второй закон термодинамики математически может быть выражен следующим образом:
dS≥  , (89)
, (89)
где dS — бесконечно малое приращение энтропии системы;
dQ—бесконечно малое количество теплоты, полученной системой от источника теплоты;
Т — абсолютная температура источника теплоты. Знак неравенства соответствует необратимым процессам, а знак равенства — обратимым процессам.
Следовательно, аналитическое выражение второго закона термодинамики для бесконечно малого обратимого процесса имеет вид
dQ = TdS (90)
а так как согласно первому закону термодинамики
dQ = dU + pdV,
то уравнение (90) принимает вид
TdS = dU + pdV.
Энтропия идеального газа
Основным уравнением для определения изменения энтропии в обратимом процессе является выражение
ds=  .. (91)
.. (91)
Поскольку в технической термодинамике приходится иметь дело не с абсолютным значением энтропии, а с ее изменением, отсчет значений энтропии можно вести от любого состояния. Для газов принято считать значение энтропии равным нулю при нормальных условиях, т. е. при р = 101 325 Па и Т =273,15 К (760 мм рт. ст. и 0° С).
Определение энтропии для любого состояния газа, отсчитанной от нормального состояния, производят по следующим формулам.
При переменной теплоемкости, исходя из линейной зависимости ее от температуры:
s = аτln  + Rln
+ Rln  (T,-273); (92)
(T,-273); (92)
s = аpln  - Rln
- Rln  (T,-273); (93)
(T,-273); (93)
s = аτln  + арln
+ арln  (T,-273); (94)
(T,-273); (94)
При постоянной теплоемкости
s = сτln  + Rln
+ Rln  ; (95)
; (95)
s = сpln  - Rln
- Rln  ; (96)
; (96)
|
|
|
s = сτln  + арln
+ арln  . (97)
. (97)
Изменение энтропии между двумя произвольными состояниями газа 1 и 2 определяют по следующим формулам.
При переменной теплоемкости, считая зависимость ее от температуры линейной:
s2-s1 = avln  + Rln
+ Rln  + b(T2-T1); (98)
+ b(T2-T1); (98)
s2-s1 = apln  + Rln
+ Rln  + b(T2-T1); (99)
+ b(T2-T1); (99)
s2-s1 = apln  + Rln
+ Rln  + b(T2-T1); (100)
+ b(T2-T1); (100)
При постоянной теплоемкости
s2-s1 = сvln  + Rln
+ Rln  . (101)
. (101)
s2-s1 = сpln  + Rln
+ Rln  . (102)
. (102)
s2-s1 = сpln  + Rln
+ Rln  . (103)
. (103)
Уравнения кривых различных термодинамических процессов в системе координат Ts имеют следующий вид (при постоянной теплоемкости):
уравнение изохоры
s2-s1 = сvln  . (104)
. (104)
уравнение изобары
s2-s1 = сpln  . (105)
. (105)

Рисунок 8 – Графическое изображение изохоры и изобары
Взаимное расположение изохоры и изобары показано на рисунке 8;
уравнение изотермы
Т = const, (106)
при этом изменение энтропии в изотермическом.процессе
si-s1 = Rln  .= Rln
.= Rln  ; (107)
; (107)
уравнение адиабаты
s = const.
Изображение изотермы и адиабаты в системе координат Ts дано соответственно на рисунке 9. и 10.
Т

s
Рисунок 9 – Графическое изображение изотермы
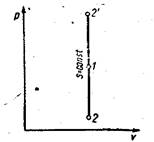
Рисунок 10 – Графическое изображение адиабаты
Уравнение политропы
si-s1 = сln  .; (108)
.; (108)
где
с = сv  .
.
Широким распространением при решении термодинамических задач пользуется диаграмма Ts. Адиабаты в этой диаграмме изображаются вертикалями, изотермы — горизонталями, изохоры и изобары идеального газа — логарифмическими кривыми.
На рисунке 11 дана -небольшая часть диаграммы Ts для воздуха, на которой нанесены изотермы, адиабаты и изобары (отсутствуют изохоры).
Необходимо иметь в виду, что значения энтропии зависят от теплоемкостей, поэтому для каждого газа нужна отдельная диаграмма Ts.

Рисунок 11 - Часть диаграммы Ts для воздуха, на которой нанесены изотермы, адиабаты и изобары (отсутствуют изохоры).
При пользовании диаграммой Ts значительно упрощается решение различных термодинамических задач, особенно в тех случаях, когда в расчетах не требуется большая точность.
|
|
|
Максимальная работа
Если работа совершается с помощью газа, параметры которого отличаются от параметров окружающей среды, то максимальная работа, которую может произвести этот газ, достижима лишь при условии его перехода от начального состояния к состоянию среды обратимым путем. При этом максимальная полезная работа меньше максимальной работы на величину работы вытеснения воздуха окружающей среды.
Величина максимальной полезной работы определяется формулой
l max (полезн) = U1 - U2 -Т0 (s1 - S2) – P0 (s1 – s2) – P0(v2-v1). (109)
В этой формуле параметры, имеющие индекс 1 и 2, относятся соответственно к начальному и конечному состоянию источника работы, а параметры с индексом 0 относятся к рабочей среде.
Так как выражения
u1 — и2 и Т0 (s1 — s2)
представляют собой соответственно абсолютную величину работы адиабатного и изотермического процесса, то формулу (109) можно представить в виде
l max (полезн.) = lид – lиз – Р0/(V2-V1)
Примеры решения задач
1.Определить энтропию 1 кг кислорода при р = 0,8 МПа и t = 250° С. Теплоемкость считать постоянной.
Ре ш е н и е:
По формуле (96)
s = сpln  - Rln
- Rln  ;
;
Так как для двухатомных газов µср = 29,3 кДж/(кмоль*К), а R = 8,314 кДж/(кмоль*К), то
s = 29,3/32 * 2,303 lg523/273 – 8,314/32 8 2,303 lg8/1,013;
s = 0,5978 — 0,5373 = 0,0605 кДж/(кг* К).
Ответ: s = 0,0605 кДж/(кг* К).
2. Найти энтропию 1 кг кислорода при р = 0,8 МПа и t = 250° С. Теплоемкость считать переменной, приняв зависимость ее от температуры линейной.
Решение
По формуле (93)
s = аpln  - Rln
- Rln  (T,-273);
(T,-273);
Из таблицы 5 для кислорода
срт = 0,9127 + 0,00012724t кДж/(кг*К).
Поэтому формула линейной зависимости истинной теплоемкости будет иметь вид
ср = 0,9127 + 0,00025448t кДж/(кг*К),
или
ср = 0,9127 + 0,00025448 (T — 273) кДж/(кг* К),
следовательно,.
ср = 0,8432 + 0,00025448T кДж/(кг*К).
Таким образом,
а = 0,8432; b = 0,00025448;
значение энтропии
s = 0,8432 * 2,303 lg 523/273 – 8,314/32 * 2,303lg 0,8/0,1013 + 0,00025488(523 – 273);
s = 0,5476 – 0,5371 + 0,0634 = 0,0739 кДЖ/(кг*К)
Для тех же условий, но при постоянной теплоемкости (смотри задачу 1) значение энтропии s = 0,0605 кДж/(кг * К), т. е. меньше на
0.0739—0,0605/ 0,0739 = 0,0134/0,0739 = 18,1%
Этот результат показывает, что для повышенных и высоких температур следует пользоваться зависимостью с = f(t)
Ответ: s = 0,0739 кДЖ/(кг*К)
3. 10м3 воздуха, находящегося в начальном состоянии при нормальных условиях, сжимают до конечной температуры 400° С. Сжатие производится: 1) изохорно, 2) изобарно, 3) адиабатно и 4) политропно с показателем политропы т = 2,2. Считая значение энтропии при нормальных условиях равным нулю и принимая теплоемкость воздуха постоянной, найти энтропию воздуха в конце каждого процесса.
|
|
|
Решение:
Находим массу 10 м8 воздуха при нормальных условиях:
М =PV/RT = 0,1013*106*10/287*273 = 12,9 кг
Определяем изменение энтропии в каждом из перечисленных процессов:
1) изохорное сжатие.
Δs1 = s1= Mcv ln = 12,9*0,723.2,303lg673/273 = 8,42 кДж/К;
2) изобарное сжатие
Δs2 = s2 = Мср In T/273 = 12,9*1,0117*2,303lg673/273 = 11,7 кДж/К;
3) адиабатное сжатие
Δs3= s3 = 0;
4) политропное сжатие
Δs4 = s4= Мсv*m-k/m-1*ln T/273 = 12,9*0,723*2,2-1,4/2,2-1*2,303lg673/273 = 5,61 кДж/К.
Ответ: Δs1=8,42 кДж/К; Δs2 = 11,7 кДж/К; Δs3= s3 = 0; Δs4 =5,61 кДж/К.
|
|
|


