 |
Обработка результатов эксперимента.
|
|
|
|
1. Рассчитывают степень ионизации индикатора α в исследуемом растворе, для чего используют соотношение: α =Ах/Аmax.
2. Для расчета рН используют уравнение:
рН= рКа+ lg α/ 1- α
3. Рассчитывают относительную ошибку эксперимента.
Расчеты:
Выводы (отмечают возможные источники ошибок эксперимента).
Занятие 12
Свойства буферных растворов.
Дата _________ Лабораторная работа
Свойства буферных растворов.
Цель работы. Научиться готовить буферные растворы и исследовать зависимость рН буферного раствора от соотношения концентраций компонентов буферной системы, разбавления и добавления сильных протолитов.
Оборудование и реактивы. Набор пробирок в штативе; бюретки вместимостью 25 мл; воронки диаметром 30 мм; пипетки вместимостью 1 мл; стеклянные палочки; капельницы с растворами; пипетки глазные.
Соляная кислота; растворы уксусной кислоты, гидроксида натрия, ацетата натрия (все по 0,1 моль/л); хлорида натрия 0,9%, раствор лакмоида в этаноле.
Сущность работы.
Для расчета рН ацетатной буферной системы используют уравнение:
 |
Анализ приведенного уравнения позволяет сделать следующие выводы: рН буферных растворов зависит от константы диссоциации сопряженной кислоты, от соотношения концентраций (количеств веществ) компонентов кислотно-основной пары, практически не зависит от разбавления раствора водой.
При введении в буферный раствор небольшого количества (X моль) сильной кислоты рН получившегося буферного раствора можно рассчитать следующим образом:
 |
где n – количество вещества компонента буфера, моль.
|
|
|
При введении в буферный раствор небольшого количества (Y моль) сильного основания, рН буферного раствора можно рассчитать по формуле:
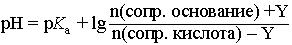 |
Ход работы.
Опыт 1. Приготовление буферных растворов с различным значением рН.
1. Готовят серию буферных растворов с разными соотношениями концентраций компонентов. Рассчитывают, какие объемы исходных растворов требуются для приготовления буферных растворов объемом по 10,0 мл с соотношением концентраций соли (CH3COONa) и кислоты (CH3COOH): в пробирке №1-1:9; в пробирке №2- 1:1; в пробирке №3-9:1. Точные объемы растворов уксусной кислоты и ацетата натрия отмеривают в пробирки из бюреток; содержимое пробирок тщательно перемешивают стеклянной палочкой.
2. Готовят серию буферных растворов с тем же соотношением концентраций соли и кислоты, но с меньшей суммарной концентрацией компонентов. Для этого пипеткой отбирают по 1,0 мл приготовленных ранее растворов и к каждому добавляют по 8,0 мл дистиллированной воды, после чего содержимое перемешивают. Таким образом, в пробирках №1 и №4, №2 и №5, №3 и №6 находятся растворы с одинаковыми соотношениями концентраций соли и кислоты, но растворы в пробирках №№4,5 и 6 являются разбавленными по сравнению с растворами в пробирках №№1,2 и 3.
3. Во все пробирки добавляют по 5 капель раствора лакмоида, после чего содержимое пробирок перемешивают. На белом фоне сравнивают окраску растворов между собой.
4. Рассчитывают рН приготовленных буферных растворов.
Экспериментальные данные
| Пробирка с исходным буферным раствором | №1 | №2 | №3 |
| С(NaCH3COO): C(CH3COOH) | |||
| Цвет буферного раствора после добавления лакмоида | |||
| рН исходного буферного раствора | |||
| Пробирка с разбавленным буферным раствором | №4 | №5 | №6 |
| С(NaCH3COO): C(CH3COOH) | |||
| Цвет разбавленного буферного раствора после добавления лакмоида | |||
| рН разбавленного буферного раствора |
Справочные данные: рКа(CH3COOH/ CH3COO-) = ________________
|
|
|
Расчет рН
Вывод к опыту 1:
Опыт 2. Влияние добавления небольших количеств сильных кислот и оснований на рН буферного раствора.
1. В пробирках №1 и №2 готовят по 10 мл буферного раствора с соотношением концентраций ацетата натрия и уксусной кислоты, равным 2:3, для чего предварительно рассчитанные объемы растворов наливают из бюреток. В пробирки №3 и №4 отбирают с помощью пипетки по 10 мл физиологического раствора (0,9% раствора хлорида натрия). Ко всем растворам добавляют по 5 капель раствора лакмоида и содержимое пробирок перемешивают. Наблюдаемую окраску записывают в таблицу. При необходимости окраску физиологических растворов выравнивают, добавляя в пробирки №3 и №4 по каплям разбавленную соляную кислоту с концентрацией 0,01 моль/л. После каждой добавленной капли кислоты раствор перемешивают стеклянной палочкой.
2. В пробирки №1 и №3 добавляют по 5 капель раствора гидроксида натрия с концентрацией 0,1 моль/л. В пробирки №2 и №4 добавляют по 5 капель соляной кислоты с концентрацией 0,1 моль/л. Все растворы перемешивают и наблюдаемую окраску записывают в таблицу.
Экспериментальные данные
| № раствора | Объект изучения | Окраска раствора после добавления лакмоида | + 5 капель HCl, с =0,1 моль/л. | +5 капель NaOH, с =0,1 моль/л. |
| 1 | Буферный раствор | ------ | ||
| 2 | Буферный раствор | ----- | ||
| 3 | Физиологический раствор | ------ | ||
| 4 | Физиологический раствор | ------ |
Вывод к опыту 2:
Занятие 13.
Гетерогенные процессы.
Дата _________ Лабораторная работа
|
|
|


