 |
Федеральное агентство по образованию
|
|
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общематематических и естественнонаучных дисциплин

Кафедра химии
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
ПО ДИСЦИПЛИНЕ
«ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
(ДЛЯ СТУДЕНТОВ ЗАОЧНОЙ ФОРМЫ ОБУЧЕНИЯ)
Часть 1
Учебно-методическое пособие
Череповец
Примеры решения задач по дисциплине «Общая и неорганическая химия» (для студентов заочной формы обучения). Ч. 1: Учеб. -метод. пособие. - Череповец: ГОУ ВПО ЧГУ, 2005. – 61 с.
Рассмотрено на заседании кафедры химии, протокол № 9 от 10. 06. 05.
Одобрено редакционно-издательской комиссией факультета общематематических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № 5 от 14. 06. 05.
Составители: О. А. Калько – канд. техн. наук, доцент;
Н. В. Кунина
Рецензенты: Г. В. Козлова – канд. хим. наук, доцент (ГОУ ВПО ЧГУ);
Т. А. Окунева (ГОУ ВПО ЧГУ)
Научный редактор: Г. В. Козлова – канд. хим. наук, доцент
© Калько О. А., Кунина Н. В., 2005
© ГОУ ВПО Череповецкий государст-
 венный университет, 2005
венный университет, 2005

ВВЕДЕНИЕ
Данное учебно-методическое пособие содержит краткие теоретические сведения и примеры решения задач по следующим разделам курса «Общая и неорганическая химия»: основные законы химии; строение атома и периодичность изменения свойств элементов; химическая связь и строение молекул. Пособие предназначено для студентов заочной формы обучения в качестве вспомогательного руководства при выполнении домашних контрольных работ. Оно также будет полезным при подготовке к экзамену или зачету. Для более глубокого изучения дисциплины необходимо также ознакомиться с соответствующими разделами учебников, рекомендуемых в программе курса. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Общая и неорганическая химия» для химических специальностей.
|
|
|
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Краткие теоретические сведения
Химия – одна из фундаментальных естественных наук, предметом изучения которой являются вещества, их свойства и превращения. Одной из центральных характеристик вещества является масса m. Истинные массы структурных составляющих вещества (атомов, молекул и др. ) очень малы (порядка 10-24¸ 10-20 г), поэтому для удобства в химии принято работать не с абсолютными, а с относительными значениями масс.
Относительная атомная масса химического элемента Аr – это величина, равная отношению средней массы атомов данного элемента (с учетом процентного содержания его изотопов в природе) к 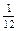 массы изотопа углерода 12 (
массы изотопа углерода 12 ( 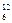 С). Значения атомных масс всех химических элементов содержатся в Периодической системе Д. И. Менделеева.
С). Значения атомных масс всех химических элементов содержатся в Периодической системе Д. И. Менделеева.
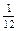 массы
массы 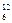 С называется атомной единицей массы (а. е. м. ),
С называется атомной единицей массы (а. е. м. ),
т. е.
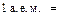
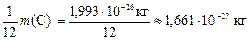 .
.
Относительная молекулярная масса вещества Mr находится как сумма Аr атомов, из которых состоит молекула.
В 1971 году в Международную систему единиц измерения (СИ) была введена единица количества вещества – моль n – такое количество вещества, которое содержит столько структурных элементарных частиц (атомов, молекул, ионов, электронов, эквивалентов и т. д. ), сколько содержится атомов в 12 г изотопа углерода 12.
|
|
|
Число атомов в 12 г 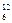 С равно 6, 02 × 1023 атомов. Это число называется постоянной Авогадро NА, которая равна NА = (6, 022045 ± ± 0, 000031) × 1023 моль-1.
С равно 6, 02 × 1023 атомов. Это число называется постоянной Авогадро NА, которая равна NА = (6, 022045 ± ± 0, 000031) × 1023 моль-1.
Таким образом, количество вещества можно оценить по формуле
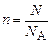 , (1)
, (1)
где N – число элементарных структурных единиц вещества.
Масса 1 моль вещества называется молярной массой M. Ее можно вычислить как отношение массы вещества m к его количеству n, кг/моль (г/моль):
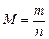 или
или  . (2)
. (2)
Численное значение М (в г/моль) совпадает с Mr вещества.
Количественные расчеты между веществами, находящимися в газообразном состоянии, удобнее производить не по массе, а по объему. Наиболее важными законами газового состояния являются законы Авогадро, Менделеева – Клапейрона и Дальтона.
Закон Авогадро: в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. Это означает, что одно и то же число молекул любого газа занимает при одинаковых физических условиях один и тот же объем. Из закона Авогадро вытекают два важных следствия.
Следствие 1. При одинаковых физических условиях (т. е. Р, Т = const) 1 моль любого газа занимает один и тот же объем, который называют молярным объемом Vм . При нормальных условиях (н. у. ) – давление 101, 325 кПа (1 атм или 760 мм рт. ст. ), температура 273 К (0 °С) – этот объем равен V  = = 22, 4 дм3/моль;
= = 22, 4 дм3/моль;
Следствие 2. Отношение масс равных объемов различных газов равно отношению их молярных масс:
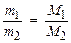 , (3)
, (3)
где m1, m2 – массы газов, г; M1, M2 – молярные массы газов, г/моль. Отношение 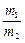 называется относительной плотностью первого газа по второму D
называется относительной плотностью первого газа по второму D 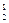 . Тогда из формулы (3) следует, что
. Тогда из формулы (3) следует, что
M1 = M2 × D 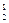 (4)
(4)
Зависимость между количеством идеального газа, его объемом, давлением и температурой можно выразить равенством, которое отражает закон Менделеева – Клапейрона:
 , (5)
, (5)
где 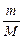 = n, моль; P – давление, Па; V – объем, м3; R =
= n, моль; P – давление, Па; V – объем, м3; R =
|
|
|
= 8, 314 Дж/(моль × К) - универсальная газовая постоянная; T – температура, К.
Если газообразная фаза представляет собой смесь нескольких газов, химически не взаимодействующих друг с другом, то общее давление такой смеси Р можно определить по закону Дальтона:
Р = Р1 + Р2 + Р3 + … , (6)
где Р – общее давление; Р1, Р2, Р3, … – парциальные давления газов 1, 2, 3, ….
Парциальным давлением газа Рi в смеси называется давление, которое производил бы этот газ, если бы при тех же физических условиях он занимал объем всей газовой смеси. Его можно рассчитать по формулам:
Рi = 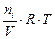 ; (7)
; (7)
Pi = xi × P, (8)
где ni – число моль i-го газа в смеси; 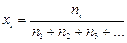 – мольная доля i-го газа в смеси.
– мольная доля i-го газа в смеси.
При количественных расчетах не обязательно записывать уравнение химической реакции и подбирать коэффициенты, если использовать понятия эквивалент и закон эквивалентов.
Эквивалентом Э (Х)называют некую реальную или условную частицу (атом, молекулу, ион, радикал и т. п. ), которая может присоединять, замещать или быть каким-либо другим образом равноценна 1 моль атомов водорода или ионов Н+ в химических реакциях. В общем случае эквивалент элемента или вещества Х можно найти по формуле
Э(Х) =  ,
,
где z* – число эквивалентности, равное тому количеству атомов или ионов водорода, которое эквивалентно (равноценно) частице Х.
Масса 1 моль эквивалента вещества или элемента Х называется молярной массой эквивалента МЭ(Х)(г/моль). Ее можно рассчитать по формуле
МЭ(Х) = М(Х) × Э(Х) = 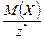 .
.
Число эквивалентности z* для химического элемента, входящего в состав какого-либо вещества, равно модулю степени окисления (с. о. ), проявляемой данным элементом в химическом соединении. Таким образом, расчет молярной массы эквивалента элемента следует вести по формуле
МЭ(элемент) = 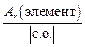 . (9)
. (9)
Для простого одноатомного вещества (например: Mg, P, S и т. д. ) z* равно наиболее характерной валентности В элемента простого вещества. Тогда
|
|
|
МЭ (Х) = 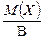 . (10)
. (10)
Правила определения значения z* веществ и формулы для расчета их молярных эквивалентных масс во всех других случаях приведены в табл. 1.
При решении задач с участием газообразных веществ обычно пользуются не МЭ, а молярным эквивалентным объемом вещества VЭ, то есть объемом, который занимает 1 моль эквивалентов газа. Расчет VЭ газа (в дм3/моль) при н. у. следует вести по формуле
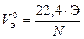 , (11)
, (11)
где Э – эквивалент элемента, составляющего газ; N – число атомов элемента в молекуле газа; 22, 4 – молярный объем газа при н. у., дм3/моль.
Достаточно часто уравнения химических реакций записывают в сокращенно-ионной форме. Для ионов МЭ вычисляют по формуле
МЭ(иона) = 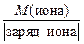 . (12)
. (12)
Таблица 1
|
|
|


