 |
Таблицы для вычисления коли-титра в продуктах
|
|
|
|
Таблица 4. 4. 3. 3.
| Объемы: 10, 0; 1, 0; 0, 1 и 0, 01 мл
| |||||
| 10, 0 | 1, 0 | 0, 1 | 0, 01 | Коли-индекс | Коли-титр |
| - | - | - | - | менее 90 | более 11, 1 |
| - | - | - | + | 11, 1 | |
| - | - | + | - | 11, 1 | |
| - | + | - | - | 10, 5 | |
| - | - | + | + | 5, 6 | |
| - | + | - | + | 5, 3 | |
| - | + | + | + | 4, 6 | |
| + | - | - | - | 4, 3 | |
| - | + | + | + | 3, 6 | |
| + | - | - | + | 1, 1 | |
| + | - | + | - | 1, 0 | |
| + | - | + | + | 0, 6 | |
| + | + | - | - | 0, 4 | |
| + | + | - | + | 0, 1 | |
| + | + | + | - | 0, 04 | |
| + | + | + | + | более 23800 | менее 0, 04 |
Таблица 4. 4. 3. 4.
| Объемы: 1, 0; 0, 1; 0, 01 и 0, 001 мл
| |||||
| 1, 0 | 0, 1 | 0, 01 | 0, 001 | Коли-индекс | Коли-титр |
| - | - | - | - | менее 900 | более 1, 11 |
| - | - | - | + | 1, 11 | |
| - | - | + | - | 1, 11 | |
| - | + | - | - | 1, 05 | |
| - | - | + | + | 0, 56 | |
| - | + | - | + | 0, 53 | |
| - | + | + | - | 0, 46 | |
| + | - | - | - | 0, 43 | |
| - | + | + | + | 0, 36 | |
| + | - | - | + | 0, 11 | |
| + | - | + | - | 0, 10 | |
| + | - | + | + | 0, 06 | |
| + | + | - | - | 0, 04 | |
| + | + | - | + | 0, 01 | |
| + | + | + | - | 0, 004 | |
| + | + | + | + | более 238000 | менее 0, 004 |
|
|
|
Таблица 4. 4. 3. 5.
| Объемы: 0, 1; 0, 01; 0, 001 и 0, 0001 мл
| |||||
| 0, 1 | 0, 01 | 0, 001 | 0, 0001 | Коли-индекс | Коли-титр |
| - | - | - | - | менее 9000 | более 0, 111 |
| - | - | - | + | 0, 111 | |
| - | - | + | - | 0, 111 | |
| - | + | - | - | 0, 105 | |
| - | - | + | + | 0, 056 | |
| - | + | - | + | 0, 053 | |
| - | + | + | - | 0, 046 | |
| + | - | - | - | 0, 043 | |
| - | + | + | + | 0, 036 | |
| + | - | - | + | 0, 011 | |
| + | - | + | - | 0, 010 | |
| + | - | + | + | 0, 006 | |
| + | + | - | - | 0, 004 | |
| + | + | - | + | 0, 001 | |
| + | + | + | - | 0, 0004 | |
| + | + | + | + | более 2380000 | менее 0, 0004 |
Таблица 4. 4. 3. 6.
|
|
|
| Объемы: 0, 01; 0, 001; 0, 0001 и 0, 00001 мл
| |||||
| 0, 01 | 0, 001 | 0, 0001 | 0, 00001 | Коли-индекс | Коли-титр |
| - | - | - | - | менее 90000 | более 0, 0111 |
| - | - | - | + | 0, 0111 | |
| - | - | + | - | 0, 0111 | |
| - | + | - | - | 0, 0105 | |
| - | - | + | + | 0, 0056 | |
| - | + | - | + | 0, 0053 | |
| - | + | + | - | 0, 0046 | |
| + | - | - | - | 0, 0043 | |
| - | + | + | + | 0, 0036 | |
| + | - | - | + | 0, 0011 | |
| + | - | + | - | 0, 0010 | |
| + | - | + | + | 0, 0006 | |
| + | + | - | - | 0, 0004 | |
| + | + | - | + | 0, 0001 | |
| + | + | + | - | 0, 00004 | |
| + | + | + | + | более 23800000 | менее 0, 00004 |
4. 5. Метод определения микроорганизмов рода Staphylococcus
Клетки стафилококков сферические, 0, 5-1, 5 мкм в диаметре. В результате деления более чем в одной плоскости образуют гроздьевидные скопления. Неподвижные, грамположительные. Образуют внеклеточные ферменты и токсины. Температурный оптимум 35-40 °С, пределы для роста 6, 5-46 °С. Оптимум рН 7, 0-7, 5, пределы рН для роста - 4, 2-9, 3. Стафилококки активно образуют пигмент (липохром) золотистый, эмалево-белый, лимонно-желтый, особенно при комнатной температуре (20 °С) и при доступе воздуха. Колонии стафилококков на плотных средах имеют форму правильных дисков от 2 до 4 мм в диаметре. Края колонки ровные, поверхность слегка выпуклая блестящая, непрозрачная, окрашена в цвет пигмента. В жидких средах дают сильное диффузное помутнение, образуя постепенно осадок. Согласно последней классификации (Берги, 1980) род Staphylococcus включает три вида: St. aureus, Staph. epidermidis, Staph. saprophyticus. Стафилококки, относящиеся ко всем трем видам, могут быть причиной различных заболеваний человека, а стафилококки, вырабатывающие энетеротоксины, при определенных условиях могут вызывать пищевые интоксикации. В настоящее время Staph. aureus целесообразно использовать в качестве санитарно-показательного микроорганизма при исследовании пищевых продуктов, а также при обследовании объектов общественного питания, особенно пищеблоков в детских дошкольных и подростковых учреждениях для оценки их санитарного содержания.
|
|
|
4. 5. 1. Методика количественного определения Staph. aureus
Методика выделения St. aureus предусматривает его количественное определение в пищевых продуктах и наличие его в смывах.
1 этап. Из исходной 10% взвеси продукта производят посев на элективные среды: желточно-солевой (ЖСА) или молочно-солевой (МСА) агары. Основную 10% взвесь в количествах 0, 5 и 0, 1 мл (0, 05 и 0, 01 г продукта) наносят на поверхность среды, равномерно распределяют и тщательно растирают шпателем. Кроме этого, 1 мл исходной взвеси (0, 1 г продукта) засевают в пробирки с 5 мл 6, 5%-го солевого бульона. Продукты жидкой консистенции высевают на плотные среды в количестве 0, 5 и 0, 1 мл, а в жидкие - 1, 0 мл. Продукты с пониженной водной активностью ( 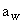 0, 86) или с повышенным содержанием поваренной соли дополнительно засевают также в количестве 1, 0 мл (0, 1 г, мл продукта) на сахарный бульон, разлитый в пробирки по 5 мл.
0, 86) или с повышенным содержанием поваренной соли дополнительно засевают также в количестве 1, 0 мл (0, 1 г, мл продукта) на сахарный бульон, разлитый в пробирки по 5 мл.
Посевы инкубируют при 37 °С в течение 18-24 часов, чашки с плотными средами оставляют еще на сутки при комнатной температуре*.
___________________
* - На средах, содержащих желток, стафилококк, выделенный от человека, образует у 60-70% выделенных культур венчик вокруг колонии (положительная лецитовителлазная реакция). Стафилококки животного происхождения дают положительную лецитовителлазную реакцию в 5-10% культур.
2 этап. а) Просматривают посевы на МСА или ЖСА. На ЖСА колонии стафилококков дают радужный венчик, на МСА - образуют пигмент: золотистый, кремовый, эмалево-белый и др. Изолированные колонии, подозрительные на стафилококк, изучают, микроскопируют с окраской по Граму и высевают на скошенный МПА или на сектора чашки с молочным агаром. Число колоний, взятых для идентификации, должно быть не менее 5-7.
|
|
|
б) Из сред обогащения производят высевы на сектора чашки с молочным агаром.
Все посевы инкубируют при 37 °С в течение 18-24 часов.
3 этап: Выделенную чистую культуру с секторов на чашках с молочным или из пробирок со скошенным МПА подвергают микроскопии с окраской по Граму. При наличии мелких грамположительных кокков ставят реакцию плазмокоагуляции.
4. 5. 2. Постановка реакции плазмокоагуляции
Наилучшим методом предварительной идентификации St. aureus в лабораторных условиях является коагулазная проба в пробирке, закрытой ватной пробкой, с кроличьей или человеческой плазмой. При чтении реакции плазмокоагуляции установлено 3 градации активности фермента коагулазы:
1) ++++ - сгусток плотный, 2) +++ - сгусток, имеющий небольшой отсек, 3) ++ - сгусток в виде взвешенного мешочка.
Эту реакцию следует читать очень осторожно, чтобы не повредить и не нарушить начало ее образования.
Постановка реакции: В пробирку с 0, 5 мл цитратной плазмы, разведенной изотоническим раствором натрия хлорида в соотношении 1: 4, вносят петлю суточной культуры стафилококка и ставят в термостат при 37 °С. Осторожно просматривают реакцию плазмокоагуляции через 30 мин, 1 час, 2-4 часа и оставляют до утра при комнатной температуре для окончательного учета. Ускорение реакции производят за счет использования 3-4 часовых бульонных культур, добавляя их в количестве 0, 1 мл к 0, 5 мл разведенной плазмы.
После полного подтверждения принадлежности выделенных штаммов к St. aureus производят подсчет колоний на плотной среде и устанавливают содержание стафилококков в 1 г (мл) исследуемого продукта.
4. 5. 3. Определение St. aureus в особо скоропортящихся продуктах, имеющих микробиологический норматив*
_____________________
* - " Временные указания по микробиологическим нормативам для ряда особо скоропортящихся продуктов и методы их исследования", М., 1982 г. Утв. МЗ СССР 30/XII-81 г. N 2510-81
В ряде продуктов общественного питания микробиологические нормативы предусматривают отсутствие St. aureus в 0, 1 г и в 1, 0 г продукта.
В тех случаях, когда отсутствие St. aureus предусматривается в 0, 1 г продукта, необходимо 1 мл 10%-й взвеси продукта, приготовленной в соответствии с п. 4. 2., внести в 9 мл солевого бульона (6, 5% NaCl). В тех случаях, когда отсутствие St. aureus предусматривается в 1 г продукта, для этих целей усредненная проба массой в 10 г растирается в стерильной ступке и отсюда делается навеска на стерильном часовом стекле или стерильном пергаменте массой 1, 0 г и засевается в 9 мл солевого бульона.
|
|
|
Посевы инкубируют при 37 °С в течение 18-24 часов. После чего из солевых бульонов производят подтверждающий посев петлей на сектора чашки Петри с желточно-солевым агаром или молочно-солевым агаром. Инкубацию посевов производят при 37 °С в течение 18-24 часов. После чего чашки просматривают. При отсутствии роста типичных колоний для St. aureus делают заключение об отсутствии этого микроорганизма в исследуемой навеске продукта (в 1, 0 г или 0, 1 г. ).
При наличии роста подозрительных на стафилококки колоний производят их изучение, как в п. п. 4. 5. 1. (этапы 2 и 3), 4. 5. 2.
При наличии коагулазоположительных St. aureus делают заключение о присутствии этого микроорганизма в исследуемой навеске продукта. Следовательно, данный продукт не соответствует требуемому нормативу - " отсутствие St. aureus в 1, 0 или 0, 1 г продукта".
4. 5. 4. Дополнительные тесты идентификации St. aureus
При наличии санитарно-эпидемиологического неблагополучия следует использовать дополнительные тесты.
Прежде всего еще раз уточнить реакцию плазмокоагуляции, с этой целью культуру пересевают 2-3 раза на скошенном МПА и повторяют постановку реакции, или рассевают культуру на чашках с мясо-пептонным агаром для проведения повторной идентификации из новых колоний стафилококков. В случае неудовлетворительных результатов целесообразно из первичных посевов взять ряд других колоний и подвергнуть их вновь идентификации.
Если выделенную культуру не идентифицировали как St. aureus, следует использовать дополнительно тесты: постановку реакции на термостабильную ДНКазу, окисление маннита, фосфатазу, лецитовителлазу.
4. 5. 4. 1. Тест на лецитовителлазу
При использовании для первичного посева среды, содержащей желток, специального дополнительного определения лецитовителлазной активности у стафилококков проводить не следует. В случае выделения культур с других сред и необходимости определения у них этого признака на чашку с желточным агаром сеют испытуемую культуру штрихом или бляшкой - последнее экономнее. Чашки инкубируют при 37 °С в течение 18-20 часов. При положительном результате вокруг колонии стафилококка образуется радужный венчик, что обусловлено выделением фермента лецитовителлазы и разложением лецитина, находящегося в среде. Реакцию следует учитывать в отраженном свете.
4. 5. 4. 2. Реакция на разложение маннита в анаэробных условиях
Используют среду, приготовленную из сухого препарата с индикатором ВР и маннитом, разливают в пробирки по 10 мл, стерилизуют при 0, 7 атм. 20 минут. Перед посевом среду освобождают от воздуха, для чего пробирки кипятят в водяной бане при 100 °С 10 мин, затем быстро охлаждают в ледяной воде и немедленно производят посев уколом. Сверху засеянную среду заливают расплавленным 2% водным агаром слоем 2-3 см, чтобы исключить попадание воздуха. Посевы термостатируют при 37 °С в течение 4 дней. Просмотр осуществляют на 2 и 4 дни. Результаты расценивают как ферментацию маннита, когда нижняя и верхняя части среды четко изменяют цвет из зеленого на синий. В этом случае микроорганизмы идентифицируют как St. aureus. Если посинеет только верхняя часть среды, то имеет место окисление маннита. Если спустя 4 дня инкубации не произошло посинения, сбраживания маннита не произошло. В 2-х последних случаях микроорганизмы относят к St. epidermidis или St. saprophyticus.
4. 5. 4. 3. Определение активности кислой фосфтазы
Среда: к 100 мл 2% МПА, расплавленного и остуженного до 45 °С, добавляют 50 мг паранитрофенилфосфата натрия, разливают в чашки Петри. Посев производят бляшками - до 20 бляшек на чашку. Реакцию можно учитывать уже через 2 часа инкубации при 37 °С. Вокруг бляшек при положительной фосфатазной пробе среда окрашивается в желтый цвет. Интенсивность окрашивания увеличивается через 18-24 часа - практически окрашивается вся среда.
4. 5. 4. 4. Тест на наличие термостабильной дезоксирибонуклеазы (ДНКазы)
ДНКаза определяется по методу, основанному на метахроматических свойствах толуидина голубого. Этот метод диффузии в агар термостабильной ДНКазы St. aureus, позволяет определить ее в концентрации примерно 0, 005 мкг.
Среда: к 1000 мл 0, 05 М трио-буфера (оксиметиламинометан), рН 9, 0, добавляют 0, 3 г ДНК, затем 10, 0 г агара дифко, 1 мл 0, 01 М СаCl 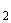 , 10, 0 г NaCl, 3, 0 мл 0, 1 М толуидина голубого. Среду разливают в пробирки по 12-15 мл, закрывают резиновыми пробками и хранят в холодильнике до 3-5 месяцев. Перед постановкой реакции среду растапливают и разливают в чашки Петри, подсушивают при 4 °С в течение 1 часа, вырезают лунки диаметром 3 мм, отсасывают пипеткой агар и вносят в лунки пастеровской пипеткой культуры, инкубируют при 37 °С.
, 10, 0 г NaCl, 3, 0 мл 0, 1 М толуидина голубого. Среду разливают в пробирки по 12-15 мл, закрывают резиновыми пробками и хранят в холодильнике до 3-5 месяцев. Перед постановкой реакции среду растапливают и разливают в чашки Петри, подсушивают при 4 °С в течение 1 часа, вырезают лунки диаметром 3 мм, отсасывают пипеткой агар и вносят в лунки пастеровской пипеткой культуры, инкубируют при 37 °С.
Перед изучением культур пробирки с суточным ростом стафилококков на полужидком агаре прогревают в кипящей водяной бане 15 минут и вносят в лунки в агаровой пластинке, содержащей толуидин голубой. Зоны просветления с розовым окрашиванием образуются в результате гидролиза ДНК, находящейся в среде, термостабильной ДНКазой стафилококков. Появление через 1-2 часа после внесения розовоокрашенных зон расценивается как положительная реакция на наличие термостабильной ДНКазы.
4. 5. 8. Идентификация стафилококков
| Дифференцирующие признаки | Наименование вида
| ||
| St. aureus | St. epidermidis | St. saprophyticus | |
| 1. Морфология с окраской по Граму | мелкие кокки, грам + | кокки, грам + | крупные кокки, грам + |
| 2. Реакция плазмокоагуляции | + | - | - |
| 3*. Ферментация маннита в анаэробных условиях | + | - | - |
| ______________ * - тесты на окисление маннита, термоустойчивую ДНКазу и кислую фосфатазу проводят в случае отрицательной р-ции плазмокоагуляции.
| |||
| 4. Лецитовителлазная актив-ть | + | ± | - |
| 5*. Тест на ДНКазу | ± | - | - |
| ______________ * - тесты на окисление маннита, термоустойчивую ДНКазу и кислую фосфатазу проводят в случае отрицательной р-ции плазмокоагуляции
| |||
| 6*. Тест на кислую фосфатазу | - | - | - |
| ______________ * - тесты на окисление маннита, термоустойчивую ДНКазу и кислую фосфатазу проводят в случае отрицательной р-ции плазмокоагуляции
| |||
4. 6. Метод определения бактерий рода Proteus
Среди пищевых токсикоинфекций этиологическим фактором могут являться бактерии рода Proteus. Обнаружение небольших количеств протея в исследуемых продуктах не является поводом для подозрения его как возбудителя пищевого отравления. Однако, факт обнаружения протея является сигналом для проведения ряда санитарно-гигиенических и профилактических мероприятий на обследуемых объектах.
К роду Proteus относятся грамотрицательные бескапсульные в основном, подвижные бактерии, разжижающие желатину и расщепляющие (….. )*, не образующие ацетилметилкарбинол и дающие положительную реакцию с метил-рот.
________________________
* Брак оригинала. Примечание " КОДЕКС".
На основании различий по некоторым ферментативным свойствам возможна дифференциация рода Proteus на две биогруппы: Proteus vulgaris, который образует индол, ферментирует мальтозу и не декарбоксилирует орнитин, и Proteus mirabilis, который не образует индола, не ферментирует мальтозу и декарбоксилирует орнитин.
4. 6. 1. Методика выделения бактерий рода Proteus
1 день.
а) для получения чистой культуры первичный посев исследуемого материала из основного разведения (10% взвесь) производят по 0, 6 мл в конденсат свежескошенного агара по методу Шукевича.
На 2-й день просматривают посевы на скошенном МПА, если наблюдается (….. )*зающий нежный вуалеобразный рост, то с верхнего края выросшей культуры готовят препарат, окрашивают по Граму и микроскопируют. При наличии грамотрицательных полиморфных палочек дают заключение о наличии бактерий рода Proteus в исследуемом продукте.
Кроме того, можно использовать посев на поверхности питательной среды Плоскирева или среды Вильсон-Блера, который производят в количестве 2, 5 мл исходной взвеси, тщательно втирая шпателем, инкубируют при (..... )* 18-24 часа. На поверхности сред Плоскирева или Вильсон-Блера вырастает О-форма протея. Для получения из О-форм колоний Н-формы одну петлю суточной бульонной культуры протея наносят на поверхность свежеприготовленных 1, 5% МПА чашек в центре чашки. Через 16-18 часов инкубирования при 37 °С наблюдается феномен “(…)*рения” - поверхность покрывается тонким слоем налета с голубоватым оттенком.
________________________
* Брак оригинала. Примечание " КОДЕКС".
После инкубации в течение 18-24 часов при 37 °С чашки с посевами просматривают и отмечают колонии, подлежащие дальнейшему исследованию. На среде Плоскирева штаммы растут в виде прозрачных колоний, слегка подщелачивая среду, которая окрашивается вокруг них в желтоватый цвет. При более длительном хранении чашек с посевами колонии мутнеют, а центр их приобретает бурую окраску. На висмут-сульфитном агаре (среда Вильсон-Блера) через 48 часов штаммы вырастают в виде изолированных колоний грязно-коричневого цвета, окраска среды под колониями не изменяется.
Если рост 18-24 часовой культуры однородный, то для дальнейшего изучения используют не менее 3-х колоний. При росте разных колоний для их изучения надо брать больше колоний, различных по внешнему виду.
При наличии характерной микроскопической картины дают заключение о присутствии бактерий рода Proteus в исследуемом продукте*.
____________________
* - Идентификацию бактерий рода Proteus проводят в случае эпидситуации на объекте в соответствии с Инструкцией о порядке расследования, учета и проведения лабораторных исследований в учреждениях санэпидслужбы при пищевых отравлениях, Москва, 1975 г.
Случайные находки бактерий рода Proteus при определении бактерий группы кишечных палочек необходимо отражать в ответе.
4. 7. Определение сальмонелл
В соответствии с рекомендациями ФАО/ВОЗ в большинстве пищевых продуктов нормируется отсутствие сальмонелл в определенной массе продукта. Сальмонеллы признаны индикаторными микроорганизмами при контроле пищевых продуктов на возможное присутствие патогенных микроорганизмов.
В особо скоропортящейся продукции общественного питания сальмонеллы не допускаются в 25 г. Анализ проводят в соответствии с Инструкцией о порядке расследования, учета и проведения лабораторных исследований в учреждениях санитарно-эпидемиологической службы при пищевых отравлениях, Москва, 1975.
|
|
|


