 |
5. Методика исследования смывов
|
|
|
|
5. МЕТОДИКА ИССЛЕДОВАНИЯ СМЫВОВ
5. 1. Объем исследования
При текущем санитарном надзоре за предприятиями общественного питания и торговли, детскими и лечебными учреждениями исследование смывов проводят на присутствие бактерий группы кишечных палочек.
Исследование на наличие St. aureus, бактерий рода Proteus, определение общей бактериальной обсемененности производится по показаниям.
Например:
а) Исследование смывов на стафилококки проводят при обследовании кремово-кондитерских цехов, столовых и ресторанов, молочных кухонь и других пищеблоков, обращая особое внимание на контроль рук персонала;
б) общую микробную обсемененность можно определять для установления эффективности санитарной обработки посуды в посудомоечных машинах, а также при оценке новых моющих и дезинфицирующих средств.
В случае повторного обнаружения бактерий группы кишечных палочек и значительном проценте смывов на объекте рекомендуется провести исследование смывов с инвентаря, оборудования и рук персонала на наличие энтеробактерий*.
___________________
* - при исследовании смывов по эпидпоказаниям производят посев тампона в смывной жидкости на среды обогащения - селенитный бульон или магниевую среду (возможно использование сред Мюллера и Кауфмана). Дальнейшее выделение и идентификацию проводят согласно Инструкции о порядке расследования, учета и проведения лабораторных исследований в учреждениях санэпидслужбы при пищевых отравлениях, М., 1975 г.
5. 2. 1. Методика посева смывов на бактерии группы кишечных палочек
При плановых санитарно-гигиенических обследованиях для выявления БГКП производят посевы смывов на среде Кесслер с лактозой или КОДА, при этом в пробирку со средой опускают тампон и переносят оставшуюся смывную жидкость.
|
|
|
Посевы на средах Кесслер или КОДА инкубируют при 37 °С, через 18-24 часа со среды Кесслер производят высев на плотную дифференциальную среду Эндо, со среды КОДА высев производят только в случае изменения окраски среды или ее помутнения. Дальнейший ход исследования см. п. п. 4. 4. 1.
5. 2. 2. Методика посева на общую бактериальную обсемененность
для определения общей обсемененности поверхностей, контролируемых предметов взятие смывов производят по методике, описанной выше (п. 4. 3. ), перед посевом в пробирку с тампоном добавляют 5 мл 0, 1% пептонной воды или изотонического раствора хлорида натрия. Тампон тщательно отмывают, после чего 1, 0 мл смывной жидкости помещают в чашку Петри и заливают расплавленным МПА. Чашки помещают в термостат при 30 °С. Предварительный подсчет выросших колоний производят через 48 часов, окончательный - через 72 часа. Количество колоний, выросших на чашке, умножают на 10 для определения общего количества бактерий, содержащихся на поверхности исследуемого предмета.
5. 2. 3. Методика посева на St. aureus
Для выявления St. aureus посев смывов производят на чашки с МСА или ЖСА, непосредственно втирая посевной материал тампоном, затем последний погружают в пробирку с 6, 5% солевым бульоном. Если необходимо определить и бактерии группы кишечных палочек, то остатки смывной жидкости переносят пипеткой в среды Кесслер или КОДА (п. 4. 4. 1. ).
5. 2. 4. Оценка результатов
Обнаружение санитарно-показательных и условно-патогенных бактерий в смывах с поверхностей чистых, подготовленных к работе предметов, инвентаря и оборудования, а также рук персонала свидетельствует о нарушении санитарного режима и дает основание для проведения административных мер.
6. РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД
|
|
|
6. 1. Изотонический раствор - 0, 85% раствор хлористого натрия
Для приготовления изотонического раствора с рН 6, 9-7, 0 используют дистиллированную воду рН, которой проверяют индикатором бромтимолбазу, при добавлении которого цвет воды должен быть бутылочно-золотым. В этих случаях воду не используют. Изотонический раствор разливают в пробирки или флаконы в необходимых количествах, стерилизуют при 1 атм. 20 мин.
6. 2. 0, 1%-й водный раствор пептона (пептонная вода)
К 1 л дистиллированной воды добавляют 1 г пептона. После размешивания среду кипятят, фильтруют и разливают по пробиркам и флаконам в необходимых количествах, стерилизуют при 1 атм. 30 мин.
6. 3. Среда для определения общего количества мезофильных аэробных и факультативно анаэробных микроорганизмов
| Сухой питательный агар (ДагНИИПО) | - 35, 0 г | |||
| Сухой экстракт кормовых дрожжей | - 2, 5 г |
| ||
| Глюкоза | - 1, 0 г |
| ||
| Вода дистиллированная | - 1000 мл |
| ||
Довести рН до 7, 0, разлить в пробирки по 15 мл, стерилизовать в течение 20 мин при 121 °С (1, 1 атм. ).
6. 4. Среда Кесслер с лактозой
К 1 л водопроводной воды прибавляют 10 г пептона и 50 мл желчи крупного рогатого скота, кипятят смесь при помешивании 20-30 мин в водяной бане и фильтруют через вату. В полученном фильтрате растворяют 2, 5 г лактозы и доводят объем до 1 л, устанавливают реакцию среды (рН 7, 4-7, 6), после чего добавляют 2 мл 1% водного раствора кристаллического фиолетового, разливают в пробирки по 5, 0 мл, 10, 0 мл и во флаконы по 50 мл. Готовая среда должна иметь темно-фиолетовый цвет. Среду стерилизуют при 1 атм. 10 мин, предварительно опустив в пробирки поплавки.
6. 5. Среда КОДА
Среду готовят по прописи на этикетке. Разливают по 5 и 10 мл в пробирки без поплавков.
6. 6. Бульон с лактозой, бычьей желчью и бриллиантовым зеленым ЖЛБ
| пептон | - 10 г | |||||
| лактоза | - 10 г |
| ||||
| сухая бычья желчь | - 20 г (или 200 мл свежей фильтрованной желчи крупного рогатого скота) |
| ||||
| бриллиантовый зеленый | - 0, 0133 г |
| ||||
| дистиллированная вода | - 1000 мл |
| ||||
Растворяют пептон и лактозу в 500 мл дистиллированной воды, добавляют бычью желчь, растворенную в 200 мл воды, смешивают, доводят объем до 950 мл, рН до 7, 4. Добавляют 13, 3 мл 0, 1% водного раствора бриллиантового зеленого, доводят общий объем водой до 1 л. Разливают в пробирки с поплавками по 10 мл. Стерилизуют 15 мин при 121 °С.
6. 7. ЕС-бульон (для подтверждающего посева на E. coli (по методу НВЧ)*
_____________________
* - пропись ФАО/ВОЗ в модификации Института питания АМН СССР.
| Сухой панкреатический гидролизат казеина | - 20, 0 г (или 10-кратное количество жидкого ПГК) с содержанием ок. 500 мг % аминного азота) | |||
| Желчь крупного рогатого скота жидкая | - 15-16 мл |
| ||
| лактоза | - 5 г |
| ||
К 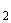 НРО НРО 
| - 4, 0 г |
| ||
КН 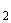 РО РО 
| - 1, 5 г |
| ||
| NaCl | - 5, 0 г |
| ||
| дистиллированная вода | - 1000, 0 мл |
| ||
Растворяют ингредиенты, доводят рН до 6, 9, разливают по 15 мл в пробирки с поплавками, стерилизуют в течение 15 мин при 121 °С.
6. 8. Среда Гисса с глюкозой
На 1 л дистиллированной воды берется 10 г пептона, 5 г хлористого натрия, 2, 5 г глюкозы. В дистиллированную воду вначале добавляют пептон, хлористый натрий и кипятят до растворения ингредиентов, затем добавляют 10 мл реактива Андреде, устанавливают рН 7, 2-7, 4, добавляют углевод и фильтруют. Среду разливают в стерильные пробирки с поплавками по 2-3 мл. Стерилизуют при 0, 5 атм. 20 мин.
Приготовление индикатора Андреде
Фукоин кислый в количестве 1 г растворяют в 200 мл дистиллированной воды, добавляют 32 мл нормального раствора едкого натра. Полученную смесь настаивают в течение 3 суток при комнатной температуре или в течение суток при 37 °С, после чего фильтруют. Реактив хранят во флаконе с притертой пробкой.
|
|
|
6. 9. Среды Эндо, Левина
Среды Эндо, Левина (эозинметиленовоголубой агар) выпускаются в сухом виде Дагестанским НИИ питательных сред, их следует готовить согласно прописям на этикетках банок. Изготовленные и разлитые в стерильные чашки Петри среды можно хранить при температуре 4 °С±1 °С до 10 суток.
6. 10. Среда для определения индолообразования
| Сухой панкреатический гидролизат казеина | - 10, 0 г | |||
| NаCl | - 5, 0 г |
| ||
| Д(….. )* -триптофан | - 1, 0 г |
| ||
| Дистиллированная вода | - 1000 мл |
| ||
_________________
* Брак оригинала. Примечание " КОДЕКС".
Довести рН до 7, 0, разлить в пробирки по 5 мл, стерилизовать 15 мин при 121 °С.
Реактив на индол
пара-диметиламинобензальдегид - 5, 0 г
соляная кислота концентрированная - 25, 0 мл
изоамиловый спирт - 75, 0 мл
6. 11. Бульон на переваре Хоттингера для определения индолообразования
В случае отсутствия среды 6. 10. используется для теста на индол.
Для приготовления бульона основной перевар Хоттингера разводят дистиллированной водой (или водопроводной) до содержания аминного азота 120-130 мг%, добавляют хлористый натрий в концентрации, 5%, фосфорнокислый двузамещенный калий (К 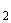 НРО
НРО  ) - 0, 1%. Устанавливают рН 7, 4-7, 6 и кипятят 15-20 минут. Приготовленный бульон фильтруют через ватно-марлевый фильтр, разливают в пробирки по 5-8 мл. Стерилизуют при 1 атм. 20 мин.
) - 0, 1%. Устанавливают рН 7, 4-7, 6 и кипятят 15-20 минут. Приготовленный бульон фильтруют через ватно-марлевый фильтр, разливают в пробирки по 5-8 мл. Стерилизуют при 1 атм. 20 мин.
Индикаторная бумажка на индол
| Спирт этиловый 96° | - 50 мл | |||
| Парадиметиаминобензальдегид | - 2, 5-3 г |
| ||
| Фосфорная кислота (конц. ) | - 10 мл |
| ||
Добавленные в спирт ингредиенты смешать до полного растворения. Полученной желтоватой жидкостью смочить край, приблизительно на 1/3, полоски фильтровальной бумаги. Цвет смоченного конца полоски бумаги должен быть желтым. При образовании индола изучаемой культурой цвет бумажки меняется от сиренево-розового до интенсивно-малинового.
6. 12. Среда Кларка
Пептон - 5-7 г
Глюкоза - 5 г
К 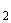 НРО
НРО  - 5 г
- 5 г
дистиллированная вода - 1000 мл
Растворить ингредиенты, довести рН до 6, 9 и профильтровать, стерилизовать 20 мин при 115 °С.
6. 13. Раствор метилового красного для теста с метил-рот
Растворить 0, 1 г метилового красного в 300 мл 90% этилового спирта. Развести до 500 мл стерильной водой, хранить при +4 °С
6. 14. Реактивы для реакции Фогеса-Проскауэра
5% альфа-нафтол: растворить 5, 0 г альфа-нафтола в 100 мл абсолютного этилового спирта. Хранить при +4 °С.
|
|
|
40% КОН. Растворить 40 г гранул КОН приблизительно в 60 мл дистиллированной воды. Разбавить до 100 мл дистиллированной водой. Хранить при +4 °С.
6. 15. Цитратная среда Козера
Na(NH  )HPO )HPO
| - 1, 5 | |||
К  НРО НРО 
| - 1, 0 г |
| ||
| магния сульфат | - 0, 2 г |
| ||
| натрия цитрат трехзамещенный | - 3, 0 г |
| ||
| дистиллированная вода | - 1000 мл |
| ||
Растворить ингредиенты в 950 мл дистиллированной воды, добавить 10 мл 0, 5% спиртового раствора бромтимолового синего. Установить рН 6, 8, проверяя значение рН на потенциометре. Довести объем дистиллированной водой до 1 л. Разлить в пробирки по 10 мл, стерилизовать в течение 15 мин при 121 °С.
6. 16. Среда Симмонса
Среда готовится аналогично среде Козера (6. 15. ), но после измерения рН в нее добавляют 20 г±0, 1 г агар-агара на 1 л, прогревают на водяной бане до растапливания агара, стерилизуют в течение 15 мин при 121 °С. Разливают в стерильные чашки Петри или пробирки.
6. 17. Среда Ресселя с мочевиной из сухих питательных сред
К 100 мл горячей стерильной дистиллированной воды добавляют 4 г сухого препарата с индикатором ВР и лактозой, 0, 1 г глюкозы и 1 г мочевины. Полученную среду разливают в стерильные пробирки по 5-6 мл и стерилизуют при 0, 5 атм. 20 мин или текучим паром 2 дня подряд по 15-20 мин.
6. 18. Трехсахарный агар с мочевиной по Олькеницкому
К 100 мл стерильного питательного агара добавляют 1 г лактозы, 0, 02 г соли Мора, 0, 03 г гипосульфита, 1 г сахарозы, 0, 1 г глюкозы, 1 г мочевины и 0, 4% раствора фенолового красного 0, 4 мл. Предварительно растворяют соль Мора с гипосульфатом в одной пробирке с небольшим количеством воды, а в другой мочевину с углеводами. После растворения все смешивают с агаром и фильтруют через стерильную марлю. Стерилизуют текучим паром 3 дня подряд по 20 мин. Горячую среду скашивают в пробирках. Незасеянная среда имеет бледно-розовый цвет.
6. 19. Солевой бульон
К 100 мл МПБ с рН 7, 0 добавляют 6, 5 г хлористого натрия. Разливают в пробирки по 5, 0 мл и стерилизуют при 1 атм. 20 мин.
6. 20. Сахарный бульон
К 100 мл стерильного бульона Хоттингера с рН 7, 2-7, 4 и содержанием 130-150 мг% аминного азота добавляют глюкозу в количестве 1, 0 г. После растворения среду разливают в пробирки по 5, 0 мл и стерилизуют при 0, 5 атм. в течение 20 мин.
6. 21. Стерильное молоко
Стерильное молоко готовят из обезжиренного молока (кислотность 16-18 °Т), которое разливают в пробирки по 10 мл. Стерилизуют при 0, 75 атм. 15 мин. Обезжиренное молоко получают путем центрифугирования или кипячения с последующим отстаиванием в цилиндре в холодильнике в течение 2 дней.
6. 22. Молочно-солевой агар
К 100 мл расплавленного и остуженного до 45 °С 2% питательного агара с концентрацией 6, 5% хлористого натрия добавляют в количестве 10 мл стерильное обезжиренное молоко. Среду тщательно перемешивают и разливают по чашкам.
6. 23. Желточно-солевой агар
Желточно-солевой агар может быть приготовлен на основе сухого питательного агара, мясо-пептонного бульона или бульона Хоттингера.
При использовании МПБ к последнему добавляют 2% агар-агара и 6, 5% хлористого натрия. При использовании бульона Хоттингера содержание аминного азота в нем должно составлять 150 мг%, для получения солевого агара добавляют 2% агар-агара и 6, 5% хлористого натрия.
В случае использования сухого питательного агара к последнему добавляют 6, 5% хлористого натрия.
Солевой агар разливают во флаконы по 200 мл и стерилизуют при 1 атм. 30 мин.
Приготовление рабочего раствора желтка
На дно стерильной чашки помещают яйцо, которое тщательно протирают ватой, смоченной спиртом. Пинцетом пробивают, с двух противоположных сторон яйца, два отверстия. Через одно из этих отверстий из яйца полностью удаляют белок, а затем, несколько увеличив отверстие, выливают желток в стерильную банку с 5-6 бусинами. К желтку постепенно добавляют, частями по 20-30 мл стерильного изотонического раствора NаCl, затем содержимое тщательно встряхивают.
Приготовление чашек
На 100 мл расплавленного и остуженного до 45 °С солевого агара добавляют 20 мл рабочего раствора желтка. После полного размешивания агар в условиях бокса разливают в чашки по 15-17 мл. Чашки можно хранить в холодильнике до 1, 5-2 недель.
6. 24. Молочный агар
К 100 мл 2% расплавленного и остуженного до 45 °С питательного агара добавляют 10 мл стерильного снятого молока. После тщательного перемешивания агар выливают в чашки по 12-15 мл.
6. 25. Цитратная плазма кролика
Цитратная плазма кролика для реакции плазмокоагуляции выпускается в сухом виде. Готовят непосредственно перед употреблением согласно прописи в прилагаемом наставлении.
6. 26. Среда для определения реакции окисления маннита в анаэробных условиях
Среду готовят из сухого препарата с индикатором ВР и маннитом по прописи на этикетке. Среду разливают в пробирки по 12-15 мл.
6. 27. Среда Плоскирева из сухих питательных сред
Среду готовят по прописи на этикетке.
6. 28. Висмут-сульфит агар (среда Вильсон-Блера)
Среду готовят по прописи на этикетке. Изготовленную и разлитую в стерильные чашки Петри среду можно хранить в холодильнике при +4 °С до 10 суток.
6. 29. Среда для определения ферментации мальтозы
Среду готовят из сухого препарата с индикатором ВР и мальтозой по прописи на этикетке. Среду разливают в пробирки по 2-3 мл.
|
|
|


