 |
Опыт №2. Качественные реакции на карбонат-ион
|
|
|
|
1) В пробирку налейте 1 мл раствора карбоната натрия и прилейте столько же раствора соляной кислоты.
Запишите наблюдения:____________________________________________
Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде:
_______________________________________________________________________________________________________________________________________________________________________________________________________________
2) К выделяющемуся газу прибавьте около 1 мл известковой воды Са(ОН)2.
Запишите наблюдения:____________________________________________
Составьте уравнение реакции в молекулярном виде: _____________________________________________________________________
Вывод:______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт №3. Качественные реакции на сульфат-ион
В пробирку налейте 1 мл раствора сульфата натрия и прилейте столько же раствора хлорида бария.
Запишите наблюдения:____________________________________________
Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде:
_______________________________________________________________________________________________________________________________________________________________________________________________________________ Вывод:______________________________________________________________________________________________________________________________________________________________________________________________________________ Опыт №4. Качественные реакции на фосфат-ион
В пробирку налейте 1 мл раствора фосфата натрия и прилейте столько же раствора нитрата серебра.
Запишите наблюдения:____________________________________________
Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде:
________________________________________________________________________________________________________________________________________________________________________________________________________________________ Вывод:_______________________________________________________________________________________________________________________________________________________________________________________________________________________
|
|
|
Экспериментальные задания:
Задание №1 Даны три пронумерованные пробирки с растворами: хлорида натрия, бромида натрия и иодида калия. Определите при помощи характерных реакций каждое из указанных веществ.
Составьте уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде: 1)_______________________________________________________________________________________________________________________________________________________________________________________________________Вывод:_________________________________________________________________________________________________________________________________ 2)_______________________________________________________________________________________________________________________________________________________________________________________________________________________Вывод:__________________________________________________________________________________________________________________________________ 3)__________________________________________________________________________________________________________________________________________________________________________________________________________________Вывод:__________________________________________________________________________________________________________________________________
Задание №2 Даны три пронумерованные пробирки с растворами: хлорида натрия, сульфата натрия и карбоната натрия. Определите при помощи характерных реакций каждое из указанных веществ.
Составьте уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде:
1)___________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________Вывод:______________________________________________________________________________________________________________________________________________2)_______________________________________________________________________________________________________________________________________________________________________________________________________________________Вывод:______________________________________________________________________________________________________________________________________________3)_______________________________________________________________________________________________________________________________________________Вывод:______________________________________________________________________________________________________________________________________
|
|
|
Задание №3. Проделайте реакции, подтверждающие качественный состав хлорида бария.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание №4. Проделайте реакции, подтверждающие, что в состав серной кислоты входят катионы водорода и сульфат анионы.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Контрольные вопросы
1. Какие реакции называются качественными?
2. Что можно определить с помощью качественного анализа?
3. Какие вещества являются реактивом для обнаружения сульфат-иона?
4. С помощью какого вещества можно определить ион хлора в соли?
5. Какие вещества служат реактивом для обнаружения карбонат-иона?
6. С помощью какого вещества можно определить ион брома в соли?
7. С помощью какого вещества можно определить ион брома в соли?
8. С помощью какого вещества можно определить фосфат-ион?
Литература
Ю.М. Ерохин «Химия» М. 2003 Глава 8 стр. 117; Глава 9 стр. 135,143; Глава 10 стр. 157
Практическое занятие №3.
«Составление структурных формул изомеров и названий предельных углеводородов».
Цель: отработка умений по составлениюструктурных формул изомеров алканов и их названий по международной систематической номенклатуре.
Теория
Алканы – это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Состав их отражает общая формула
С n H 2 n +2.
Первые четыре члена гомологического ряда метана получили исторически сложившиеся названия. Основой названия следующих алканов нормального строения стали греческие числительные (см. таблицу).
Для составления названий органических веществ по номенклатуре ИЮПАК необходимо знать формулы и названия радикалов. Радикал – это одновалентная частица, которая получается при отщеплении от молекулы алкана атома водорода, т.е. частица, содержащая неспаренный электрон. Название радикала происходит от названия соответствующего алкана с заменой суффикса –ан на суффикс –ил (см. таблицу).
| Название | Формула | Формула радикала | Название радикала |
| Метан | СН4 | СН3- | Метил |
| Этан | С2Н6 | С2Н5- | Этил |
| Пропан | С3Н8 | С3Н7- | Пропил |
| Бутан | С4Н10 | С4Н9- | Бутил |
| Пентан | С5Н12 | С5Н11- | Пентил |
| Гексан | С6Н14 | С6Н13- | Гексил |
| Гептан | С7Н16 | С7Н15- | Гептил |
| Октан | С8Н18 | С8Н17- | Октил |
| Нонан | С9Н20 | С9Н19- | Нонил |
| Декан | С10Н22 | С10Н21- | децил |
Изомеры – это вещества, имеющие одинаковые молекулярные, но разные структурные формулы и, следовательно, разные свойства.
|
|
|
Например, у вещества бутана, имеющего формулу С4Н10, есть два изомера, имеющие следующие структурные формулы
СН3 – СН2 – СН2 – СН3 и СН3 – СН – СН3.
ï
СН3
 Запомни! Чтобы среди веществ найти изомеры, надо структурные формулы свернуть в молекулярные. У изомеров молекулярные формулы будут одинаковые. Например:
Запомни! Чтобы среди веществ найти изомеры, надо структурные формулы свернуть в молекулярные. У изомеров молекулярные формулы будут одинаковые. Например:
а)СН3 – СН2 – СН2 – СН3 (С4Н10); б) СН3 – СН2 – СН – СН3 (С5Н12); в) СН3 – СН – СН3 (С4Н10)
ï ï
СН3 СН3
Таким образом, вещество а) и в) изомеры, т.к. имеют разное строение, но одинаковую молекулярную формулу - С4Н10.
В соответствии с международной номенклатурой следует придерживаться следующих правил при составлении названия алканов.
1. В структурной формуле выбирают самую длинную цепь атомов углерода (главную цепь).
2. Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе разветвление – боковая цепь.
3. В начале названия перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствуют несколько одинаковых радикалов (два, три, четыре и т.д.), то перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д.
|
|
|
4. Основой названия служит наименование предельного углеводорода с тем же числом атомов углерода, что и в главной цепи.
Задание 1. (образец) Назовите вещества
1 2 3 4
СН3 - СН- СН2 - СН3 (С5Н12)
ï
СН3
2- метилбутан
СН3 СН3
1 ï2 3 4 5 6 5 4 3 ï2 1
СН3 - СН- СН2 - СН - СН2 - СН3 (С8Н18) СН3 - СН- СН2 - С - СН3 (С8Н18)
ï ï ï
СН3 СН3 СН3
2,4 – диметилгексан 2,2,4 - триметилпентан
8 7 6 5 4 3 2 1
СН3 - СН2 - СН- СН2 - СН2 - СН2 - СН - СН3 (С11Н24)
ï ï
С2Н5 СН3
2-метил-6-этилоктан
Найди, есть ли изомеры среди вышеперечисленных веществ.
Приведите три доказательства, что вышеперечисленных вещества гомологи.
Ответ: 2,4 – диметилгексан и 2,2,4 – триметилпентан изомеры, т.к. имеют одинаковую молекулярную формулу С8Н18.
Вышеперечисленные вещества гомологи, т.к. 1) имеют одинарную связь; 2) гомологическую формулуСn H2n+2; 3) суффикс –ан в названии.
Задание 2. (образец) Напишите структурную формулу 2,4-диметилпентана, составьте структурные формулы: а) гомолога с более длинной углеродной цепью; б) изомера. Назовите их.
Алгоритм. 1. 2,4-диметил пентан – корень слова «пентан», пишем главную цепь С-С-С-С-С.
2. Нумеруем главную цепь, в положении 2 и 4 ставим два радикала «метил»
1 2 3 4 5
С-С-С-С-С
ï ï
СН3 СН3
3. В основной (главной) цепи доставим недостающие атомы Н (в соответствии с валентностью)
1 2 3 4 5
СН3-СН-СН2-СН-СН3
ï ï
СН3 СН3
а)  Запомни! Чтобы составить гомолог надо структурную исходную формулу вещества свернуть в молекулярную. Гомолог будет отличаться на одну или несколько СН2- групп.
Запомни! Чтобы составить гомолог надо структурную исходную формулу вещества свернуть в молекулярную. Гомолог будет отличаться на одну или несколько СН2- групп.
1 2 3 4 5
СН3-СН-СН2-СН-СН3 (С7Н16)
ï ï
СН3 СН3
Следовательно, гомолог с более длинной углеродной цепью, может иметь формулу С8Н18
|
|
|
СН3 - СН2 - СН2 - СН2 - СН2 - СН2 - СН2 - СН3
октан
б) изомер имеет туже формулу С7Н16, но другое строение
СН3 - СН2 - СН2 - СН2 - СН2 - СН - СН3
ï
СН3
2-метилгептан
@ Задание. Используя образцы решений, выполни следующее задания:
1. Назовите вещества
СН3 - СН- СН2 - СН3
ï
СН3
_______________________
СН3 СН3
ï ï
СН3 - СН- СН2 - СН - СН3 СН3 - С- СН2 - СН -СН2 - СН3
ï ï ï
СН3 СН3 СН3
______________________________ ______________________________________
СН3 - СН2 - СН- СН2 - СН - СН3
ï ï
С2Н5 СН3
_______________________________
Найди, есть ли изомеры среди вышеперечисленных веществ.
Приведите три доказательства, что вышеперечисленные вещества гомологи.
Ответ: _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Напишите структурные формулы: а) 2-метилгексана, б) 2,2- диметилпентана, в) 2-метилбутана, г) 2,3,5 –триметилгексана, д) 3,3 –диметилгексана, е) 2,4 – диметил-3- этилоктана. Для вышеперечисленных веществ составьте структурные формулы: а) гомологов с менее длинной углеродной цепью; б) изомеров. Назовите их.
| Структурные формулы. | Гомологи с менее длинной углеродной цепью: | Изомеры: | |
| а) 2-метилгексан |
Продолжение задания 2
| Структурные формулы. | Гомологи с менее длинной углеродной цепью: | Изомеры: | |
| б) 2,2- диметилпентан | |||
| в) 2-метилбутан | |||
| г) 2,3,5 –триметилгексан | |||
| д) 3,3 –диметилгексан | |||
| е) 2,4 – диметил-3- этилоктан |
Контрольные вопросы
1. Какие углеводороды относятся к алканам?
2. Что такое радикал? Каким образом складывается название радикалов?
3. Дайте определение изомеров. Приведите примеры изомеров.
4. Перечислите сходства гомологов ряда метана (алканов).
5. Основные правила составления названия алканов (основы международной номенклатуры).
Лабораторное занятие №6
«Получение этилена и изучение его свойств»
Цель: закрепление знаний о свойствах непредельных углеводородов: способности алкенов вступать в реакции присоединения, окисления, горения; изучение качественных реакций на непредельные углеводороды.
Теория
Этилен - С2Н4 является простейшим представителем непредельных углеводородов с одной двойной связью: СН2 = СН2.
Получение.
1. В промышленности этилен выделяют из газов крекинга (расщепления) нефти. Важнейший способ получения этилена - дегидрирование этана над никелевым катализатором:
СН3 – СН3 ® СН2=СН2 + Н2
2. В лаборатории получают дегидратацией этилового спирта (отщепление воды). Воздействие водоотнимающих средств (конц. Н2SO4) на одноатомные спирты при высокой температуре, приводит к отщеплению молекулы воды и образованию двойной связи:
СН3 – СН2ОН ® СН2=СН2 + Н2О
В создании двойной связи между двумя атомами углерода участвуют две пары электронов, причем одна связь – прочная, а другая связь слабая, легко разрывается, что и объясняет ненасыщенных характер органических соединений с двойной связью и сказывается на их химических свойствах.
I. Так, для непредельных углеводородов ряда этилена характерны реакции присоединения, которые протекают с разрывом двойной связи.
1. Реакция гидрирования: СН2=СН2 + Н2 ® СН3 - СН3
2. Реакция галогенирования: СН2=СН2 + Вr2 ®СН2Вr - СН2Вr
При взаимодействии с алкенами бромная вода обесцвечивается, поэтому реакция с бромной водой является качественной на непредельные углеводороды.
3. Реакция гидрогалогенироеания: СН3 — СН=СН2 + НВr ® СН3 – СНВr - СН3
Присоединение галогеноводородов к алкенам происходит по правилу Марковникова: атом водорода присоединяется к более гидрированному атому углерода (при котором больше содержится атомов водорода), а галоген - к менее гидрированному атому углерода.
4. Реакция гидратации: этен, присоединяя воду, образует этиловый спирт.
СН2=СН2 + Н2О® СН3 – СН2ОН
II. Реакции окисления
1. Реакция горения: алкены горят с образованием углекислого газа и воды.
С2Н4 + 3О2 ® 2СО2 + 2Н2О
2. Реакция окисления: этилен окисляются водным раствором КМnO4 до
этиленгликоля:
СН2=СН2 + [О] + НОН ® СН2ОН – СН2ОН
Реакция с КМnO4 является качественной реакцией на непредельные углеводороды, т.к. фиолетовый раствор перманганата калия в ходе реакции обесцвечивается.
III. Реакции полимеризации.
7. Реакция полимеризации протекает за счет разрыва кратных связей, с
образованием высокомолекулярного соединения (полимера).
nСН2=СН2 ® (-СН2-СН2-)n
Порядок выполнения работы
Оборудование и реактивы: лабораторный штатив; спиртовка; три пробирки; пробка с газоотводной трубкой; прокаленный песок или кусочек пемзы; смесь этилового спирта и концентрированной серной кислоты (1: 2); подкисленный раствор перманганата калия.
Опыт №1.Получение этилена
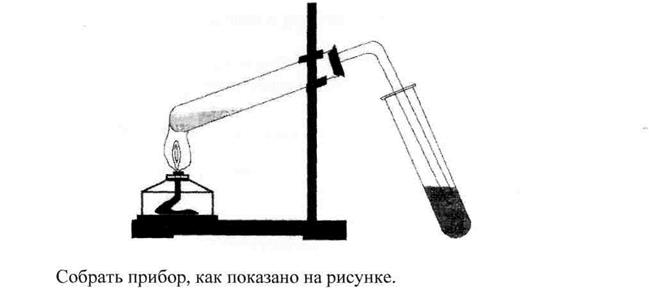
Налить в пробирку 10-15 мл смеси этилового спирта с концентрированной серной кислотой. Для равномерного кипения прибавить в смесь около 0,5 г прокаленного речного песка или опустить кусочек пемзы. Закрыть пробирку пробкой с газоотводной трубкой, укрепить ее в зажиме штатива и нагреть в пламени спиртовки.
Напишите уравнение реакции получения этилена и подпишите названия веществ:
____________________________________________________________________
Вывод:____________________________________________________________________________________________________________________________________ Опыт №2. Горение этилена
К концу газоотводной трубки поднесите горящую спичку.
Запишите наблюдения: __________________________________________________ ________________________________________________________________________ Напишите уравнение реакции:______________________________________________
Вывод:__________________________________________________________________________________________________________________________________________________________________________________________________________________
|
|
|


