 |
Hg + CuCl2 → HgCl2 + Cu
|
|
|
|
Hg + CuCl2 → HgCl2 + Cu
- Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
K2Cr2O7 + 3Na2SO3 + H2SO4 → Cr2(SO4)3 +3Na2SO4 +K2 SO4 + 4H2O
- Некоторые соли разлагаются при нагревании:
CuCO3 → CuO +CO2 ↑
- Соли взаимодействуют с неметаллами с образованием новой соли и нового неметалла реализуется только для элементов главной подгруппы VII группы (F, Cl, Br, I). Каждый из них вытесняет последующие из растворов их солей.
2NaCl + F2 = 2NaF + Cl2
2KBr + Cl2= 2KCl + Br2
1. 3. Понятие о химическом равновесии
Скорость любой химической реакции зависит от условий, в которых она протекает: от концентрации реагентов (или их давления, если это газы), температуры, наличия катализатора или излучения и т. д. Одни реакции протекают практически мгновенно (например, нейтрализация кислоты основанием), другие при обычных условиях идут настолько медленно, что заметные изменения концентраций реагентов наблюдаются лишь через несколько лет (например, взаимодействие водорода с кислородом с образованием воды в отсутствие катализатора). При этом существует множество реакций, протекающих с вполне измеримыми скоростями в обычных условиях.
Факторы, влияющие на скорость химической реакции:
1) Природа реагирующих веществ (характер связи в молекулах реагентов);
2) Концентрация реагентов;
3) Температура;
4) Катализатор;
5) Давление (для газов);
6) Излучение (ИК-, УФ-, рентгеновское, радиоактивное и др. );
7) Площадь поверхности раздела фаз (для гетерогенных реакций).
Если слить растворы кислоты и щелочи, образуется соль и вода, например,
|
|
|
HCl + NaOH → NaCl + H2O,
и если вещества были взяты в нужных пропорциях, раствор имеет нейтральную реакцию и в нем не остается даже следов соляной кислоты и гидроксида натрия. Если попытаться провести реакцию в растворе между образовавшимися веществами – хлоридом натрия и водой, то никаких изменений не обнаружится. В подобных случаях говорят, что реакция кислоты со щелочью необратима, т. е. обратная реакция не идет. Практически необратимы при комнатной температуре очень многие реакции, например:
H2 + Cl2 → 2HCl
Многие реакции обратимы уже в обычных условиях, это означает, что в заметной степени протекает обратная реакция. Например, если попытаться нейтрализовать щелочью водный раствор очень слабой хлорноватистой кислоты, то окажется, что реакция нейтрализации до конца не идет и раствор имеет сильнощелочную среду:
|
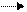


Это означает, что реакция обратима, т. е. продукты этой реакции, реагируя друг с другом, частично переходят в исходные соединения. В результате раствор имеет щелочную реакцию. Обратима реакция образования сложных эфиров (обратная реакция называется омылением):
|


Как и многие другие понятия в химии, понятие обратимости во многом условно. Обычно необратимой считают реакцию, после завершения которой концентрации исходных веществ настолько малы, что их не удается обнаружить (конечно, это зависит от чувствительности методов анализа). При изменении внешних условий (прежде всего температуры и давления) необратимая реакция может стать обратимой и наоборот. Так, при атмосферном давлении и температурах ниже 1000° С реакцию

 2Н2 + О2 2Н2О
2Н2 + О2 2Н2О
еще можно считать необратимой, тогда как при температуре 2500° С и выше вода диссоциирует на водород и кислород примерно на 4%, а при температуре 3000° С – уже на 20%.
|
|
|
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.
Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием.
При достижении состояния химического равновесия, концентрации веществ (исходных и продуктов) в системе уже не изменяются и называются равновесными. Но, в отличие от механического равновесия, при котором всякое движение прекращается, при химическом равновесии обе реакции – и прямая, и обратная – продолжают идти, однако их скорости равны и поэтому кажется, что никаких изменений в системе не происходит.
|
|
|


